NEWS
NEWS
Researchers show how mutations in ‘dark genome’ cause pancreatic malformations
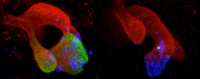
Mice with a deletion in the pancreas agenesis enhancer do not express PTF1A (green) in embryonic multipotent pancreatic progenitors, leading to underdeveloped pancreas and insulin-deficient diabetes. Immunofluorescence of embryonic pancreatic buds from control (left) and enhancer-deleted (right) mice stained for PTF1A (green), PDX1 (red), glucagon (blue). Credit: Miguel Angel Maestro/CRG/Developmental Cell
Researchers at the Centre for Genomic Regulation (CRG) have identified a DNA sequence that is crucial for pancreatic differentiation and function – and for the first time – describe how it works.
Patients with mutations in a DNA sequence - which they coin EnhP - develop pancreas malformations. It is the most clear-cut example to date of an inherited disease that is caused by mutations that do not disrupt the DNA sequence of a gene.
Disorders caused by mutations in a single DNA sequence, for example Huntington disease or sickle cell anaemia, are known as monogenic diseases. In the vast majority of cases, such mutations disrupt a protein-coding gene. In this case, the mutations in EnhP disrupt a single “enhancer” instead of a single gene.
Our genomes contain hundreds of thousands of DNA elements that are thought to act as enhancers. These enhancer DNA sequences act as switches to turn on the transcription of each gene in the right tissues.
According to the authors of the study, published today in Developmental Cell, EnhP is by no means the only enhancer defect to cause disease. Mutations in enhancers may be the cause of a monogenic disease in many patients in which laboratory tests have failed to disclose causal gene mutations.
Understanding the role of enhancers in disease could change how we practice medicine.
“Clinical genetics is shifting from a focus on sequencing protein-coding genes to sequencing whole genomes. It is now theoretically possible to discover disease-causing mutations that lie outside of traditional areas of the genome, although it is still challenging to discern which parts of the genome are truly vulnerable to mutations,” explains Dr. Jorge Ferrer, senior author of the study, Coordinator of the Medical Genomics Transversal Programme at the CRG and Group Leader at CIBERDEM.
The researchers had previously discovered EnhP when studying developmental disorders across ten different families. In collaboration with a team in Exeter, United Kingdom, they had found that mutations in the enhancer were the most common cause of pancreatic agenesis, a rare congenital disorder causing loss of pancreatic tissue and neonatal diabetes.
In this study, researchers developed on their previous work to explain why this particular enhancer is vulnerable to disease-causing mutations. Using CRISPR, the team genetically-engineered mouse models to study the effects of the enhancer. Mice lacking both copies of EnhP were born with a severely underdeveloped pancreas and insulin-deficient diabetes. They also studied human stem cells in vitro.
They show that EnhP works by increasing rates of transcription of a nearby gene known as the pancreas associated transcription factor 1a (PTF1A). More specifically, the studies revealed that EnhP’s only role is to activate a whole cluster of enhancers that also regulate PTF1A in the very first cells that form the pancreas during fetal development. When these other enhancers are activated and PTF1A transcription is turned on, this sets in motion a cascade of molecular events that lead to formation of normal pancreatic cells.
“We show that enhancers operate in a hierarchical manner, and this one sits straight at the top, says Dr. Ferrer. This is a new concept, and it solves a paradox of how mutations in a single enhancer can be catastrophic despite the existence of multiple other enhancers regulating the same gene. This is not just about this particular enhancer or disease, there are probably many other enhancers with this particular function in the human genome. Finding them will help us understand which enhancers are vulnerable to mutations that cause various other monogenic diseases”.
The discovery also has ramifications for efforts to generate insulin-producing beta cells in laboratory conditions. Cell transplantation is a feasible option for diabetic patients, but the demand for functional cells from dead donors far outstrips supply.
Growing beta cells in culture would be one way of addressing this challenge, but these rarely share the same functional features as normal human beta cells. This is in part because we don’t know the mechanisms required for proper differentiation.
“EnhP sparks a molecular program that is needed for proper formation of human beta cells. This knowledge can be harnessed to improve laboratory conditions to create beta cells” concludes Dr. Ferrer.
This research was supported by the Spanish Ministry of Science and Innovation, the Wellcome Trust, CIBERDEM and the European Research Council. The work was co-led by first co-authors Irene Miguel-Escalada, Miguel Ángel Maestro, Diego Balboa and senior author Jorge Ferrer.
Reference: Pancreas agenesis mutations disrupt a leadenhancer controlling a developmental enhancercluster. Miguel-Escalada et al., 2022, Developmental Cell 57, 1–15 August 22, 2022 Published by Elsevier Inc.https://doi.org/10.1016/j.devcel.2022.07.014
EN CASTELLANO
Mutaciones en el "genoma oscuro" causan malformaciones pancreáticas
Un equipo científico del Centro de Regulación Genómica (CRG) ha identificado una secuencia de ADN que es crucial para la diferenciación y función pancreática, y describe por primera vez cómo funciona.
Las mutaciones en esta secuencia de ADN – denominada EnhP por los autores del estudio – causan malformaciones en el desarrollo del páncreas. Se trata del ejemplo más claro de una enfermedad hereditaria causada por mutaciones que no interrumpen la secuencia de ADN de un gen.
Las enfermedades causadas por mutaciones en una sola secuencia de ADN, como la enfermedad de Huntington o la fibrosis quística, son conocidas como enfermedades monogénicas. En la gran mayoría de los casos se trata de mutaciones que interrumpen la función de un gen que codifica una proteína.
En lugar de un gen, este estudio muestra que las mutaciones en EnhP interrumpen la función de un elemento del ADN conocido como un potenciador, o enhancer en inglés. Los potenciadores actúan como interruptores para que cada gen active la transcripción únicamente en los tejidos donde ejercen una función. Se estima que existen cientos de miles de interruptores en el genoma humano.
Según los autores del estudio, publicado hoy en la revista Developmental Cell, el EnhP no sería el único potenciador que alberga mutaciones que causan una enfermedad. Las mutaciones en potenciadores podrían ser la causa de enfermedad en muchos casos de pacientes en los que los análisis genéticos no encuentran mutaciones genéticas causales.
Una mayor comprensión del papel que desempeñan los potenciadores genómicos en el desarrollo de enfermedades tendría implicaciones importantes para la medicina moderna.
"Vivimos en una época en que la genética clínica se está transformando. Hasta ahora la búsqueda de mutaciones se ceñía a las partes de nuestro genoma donde están los genes que codifican proteínas, pero ahora es posible obtener la secuencia del genoma completo de cada persona. Esto significa que es teóricamente posible descubrir mutaciones causantes de enfermedades que se encuentran fuera de las zonas tradicionales de análisis del genoma. Sin embargo, todos albergamos muchísimas mutaciones que no tienen consecuencias, y sigue siendo muy difícil discernir qué partes del genoma son vulnerables a mutaciones que realmente tienen capacidad de causar una enfermedad," explica el Dr. Jorge Ferrer, autor principal del estudio, Coordinador del Programa Transversal de Genómica Médica en el CRG y Jefe de Grupo en el CIBERDEM.
El equipo científico ya había descubierto el EnhP estudiando los trastornos del desarrollo en diez familias diferentes. En colaboración con un equipo en Exeter, en el Reino Unido, descubrieron que las mutaciones en el potenciador eran la causa más común de agenesia pancreática, un trastorno congénito raro que causa pérdida de tejido pancreático y diabetes neonatal.
El nuevo estudio es un seguimiento del trabajo para explicar por qué este potenciador en particular es vulnerable a las mutaciones que causan la enfermedad. Usando técnicas CRISPR de edición genómica, el equipo desarrolló nuevos modelos de ratón para estudiar los efectos del potenciador. Los ratones que carecían de ambas copias del EnhP nacieron con malformaciones del páncreas y diabetes al nacer. También estudiaron los efectos de estas mutaciones en células del páncreas generadas a partir de células madre humanas.
Descubrieron que el EnhP funciona aumentando las tasas de transcripción de un gen cercano conocido como el factor de transcripción asociado al páncreas 1a (PTF1A por sus siglas en inglés). Pero más específicamente, vieron que la única función del EnhP es activar todo un grupo de potenciadores que también regulan PTF1A en las células progenitoras que formarán el páncreas durante el desarrollo fetal. Cuando estos otros potenciadores y la transcripción de PTF1A se activan, se pone en marcha una sucesión de eventos moleculares que conducen a la formación de células pancreáticas normales.
"Demostramos que los potenciadores operan de manera jerárquica, y el EnhP se encuentra directamente en la cima", afirma el Dr. Ferrer. “Es un concepto nuevo, y resuelve la paradoja de cómo las mutaciones en un solo potenciador pueden ser catastróficas, aunque existan muchos otros potenciadores que regulan el mismo gen. Creemos que el hallazgo no solo es relevante a esta secuencia de ADN o a esta enfermedad en particular, sino que probablemente hay muchos otros potenciadores con esta función en el genoma humano. Encontrarlos nos ayudará a comprender qué otros potenciadores son vulnerables a mutaciones causantes de otras enfermedades monogénicas".
El descubrimiento también tiene ramificaciones para generar células beta productoras de insulina en el laboratorio. El trasplante de células es una opción factible para la diabetes, pero la demanda de células funcionales de donantes supera con creces el suministro.
La generación de células beta artificiales es una forma de abordar este reto, pero actualmente las células que se producen no comparten las mismas características funcionales que las células beta humanas normales. Esto se debe a que aún no conocemos todos los mecanismos necesarios para una diferenciación adecuada.
"El EnhP desencadena un programa molecular que es necesario para la formación adecuada de células beta humanas durante el desarrollo fetal. Este conocimiento se puede aprovechar para mejorar las condiciones de laboratorio para crear células beta plenamente funcionales", concluye el Dr. Ferrer.
El estudio cuenta con el apoyo del Ministerio de Ciencia e Innovación, el Wellcome Trust, el CIBERDEM y el Consejo Europeo de Investigación, y lo firman los primeros co-autores Irene Miguel-Escalada, Miguel Ángel Maestro, Diego Balboa y el autor principal Jorge Ferrer.
Referencia: Pancreas agenesis mutations disrupt a leadenhancer controlling a developmental enhancercluster. Miguel-Escalada et al., 2022, Developmental Cell 57, 1–15 August 22, 2022 Published by Elsevier Inc.https://doi.org/10.1016/j.devcel.2022.07.014
EN CATALÀ
Mutacions al “genoma obscur” causen malformacions pancreàtiques
Un equip científic del Centre de Regulació Genòmica (CRG) ha identificat una seqüència d’ADN que és crucial per a la diferenciació i funció pancreàtica, i descriu per primer cop com funciona.
Les mutacions en aquesta seqüència d’ADN –denominada EnhP pels autors de l’estudi- causen malformacions en el desenvolupament del pàncrees. Es tracta de l’exemple més clar d’una malaltia hereditària causada per mutacions que no interrompen la seqüència d’ADN d’un gen.
Les malalties causades per mutacions en una sola seqüència d’ADN, com la malaltia de Huntington o la fibrosi quística, són conegudes com a malalties monogèniques. En la gran majoria dels casos es tracta de mutacions que interrompen la funció d’un gen que codifica una proteïna.
En lloc d’un gen, aquest estudi mostra que les mutacions EnhP interrompen la funció d’un element de l’ADN conegut com a un potenciador, o enhancer en anglès. Els potenciadors actuen com a interruptors per a què cada gen activi la transcripció únicament en els teixits on exerceixen una funció. S’estima que existeixen centenars de milers d’interruptors en el genoma humà.
Segons els autors de l’estudi, publicat avui a la revista Developmental Cell, l’EnhP no seria l’únic potenciador que alberga mutacions que causen una malaltia. Les mutacions en potenciadors podrien ésser la causa de malalties en molts casos de pacients en els quals les anàlisis genètiques no troben mutacions genètiques casuals.
Una millor comprensió del paper que exerceixen els potenciadors genòmics en el desenvolupament de malalties tindria implicacions importants per a la medicina moderna.
“Vivim en una època en què la genètica clínica s’està transformant. Fins ara la cerca de mutacions se cenyia a les parts del nostre genoma on estan els gens que codifiquen proteïnes, però ara és possible obtenir la seqüència del genoma complet de cada persona. Això significa que és teòricament possible descobrir mutacions causants de malalties que es troben fora de les zones tradicionals d’anàlisi del genoma. Tanmateix, tots alberguem moltíssimes mutacions que no tenen conseqüències, i continua essent molt difícil discernir quines parts del genoma són vulnerables a mutacions que realment tenen capacitat de causar una malaltia,” explica el Dr. Jorge Ferrer, autor principal de l’estudi, coordinador del Programa Transversal de Genòmica Mèdica al CRG i Cap de Grup al CIBERDEM.
L’equip científic ja havia descobert l’EnhP estudiant els trastorns del desenvolupament en deu famílies diferents. En col·laboració amb un equip d’Exeter, al Regne Unit, descobriren que les mutacions en el potenciador eren la causa més comuna d’agenèsia pancreàtica, un trastorn congènit rar que causa pèrdua de teixit pancreàtic i diabetis neonatal.
El nou estudi és un seguiment del treball per explicar per què aquest potenciador en particular és vulnerable a les mutacions que causen la malaltia. Usant tècniques CRISPR d’edició genòmica, l’equip desenvolupà nous models de ratolí per a estudiar els efectes del potenciador. Els ratolins als quals mancaven ambdues còpies de l’EnhP nasqueren amb malformacions del pàncrees i diabetis en néixer. També estudiaren els efectes d’aquestes mutacions en cèl·lules del pàncrees generades a partir de cèl·lules mare humanes.
Descobriren que l’EnhP funciona augmentant les taxes de transcripció d’un gen proper conegut com a el factor de transcripció associat al pàncrees 1a (PTF1A per les seves sigles en anglès). Però més específicament, van veure que l’única funció de l’EnhP és activar tot un grup de potenciadors que també regulen PTF1A en les cèl·lules progenitores que formaran el pàncrees durant el desenvolupament fetal. Quan aquests altres potenciadors i la transcripció de PTF1A s’activen, es posa en marxa una successió d’esdeveniments moleculars que duen a la formació de cèl·lules pancreàtiques normals.
“Demostrem que els potenciadors operen de manera jeràrquica, i l’EnhP es troba directament al cim”, afirma el Dr. Ferrer. “És un concepte nou, i resol la paradoxa de com les mutacions en un sol potenciador poden ser catastròfiques, tot i que existeixin molts d’altres potenciadors que regulen el mateix gen. Creiem que la troballa no només és rellevant per a aquesta seqüència d’ADN o aquesta malaltia en particular, sinó que probablement hi ha molts d’altres potenciadors amb aquesta funció al genoma humà. Trobar-los ens ajudarà a comprendre quins d’altres potenciadors són vulnerables a mutacions causants d’altres malalties monogèniques”.
El descobriment també té ramificacions per a generar cèl·lules beta productores d’insulina al laboratori. El transplantament de cèl·lules és una opció factible per a la diabetis, però la demanda de cèl·lules funcionals de donants supera amb escreix el subministrament.
La generació de cèl·lules beta artificials és una forma d’abordar aquest repte, però actualment les cèl·lules que es produeixen no comparteixen les mateixes característiques funcionals que les cèl·lules beta humanes normals. Això és degut al fet que encara no coneixem tots els mecanismes necessaris per a una diferenciació adequada.
“L’EnhP desencadena un programa molecular que és necessari per a la formació adequada de cèl·lules beta humanes durant el desenvolupament fetal. Aquest coneixement es pot aprofitar per a millorar les condicions de laboratori per a crear cèl·lules beta plenament funcionals”, conclou el Dr. Ferrer.
L’estudi compta amb el suport del Ministerio de Ciencia e Innovación, el Wellcome Trust, el CIBERDEM, i el Consell Europeu de Recerca (ERC), i el signen els primers co-autors Irene Miguel-Escalada, Miguel Ángel Maestro, Diego Balboa i l’autor principal Jorge Ferrer.
Referència: Pancreas agenesis mutations disrupt a leadenhancer controlling a developmental enhancercluster. Miguel-Escalada et al., 2022, Developmental Cell 57, 1–15 August 22, 2022 Published by Elsevier Inc.https://doi.org/10.1016/j.devcel.2022.07.014