NEWS
NEWS
DNA damage repaired by antioxidant enzymes
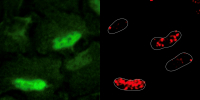
The image illustrates the location of DNA damage (in the nucleus of these four cells – green) and the colocalization of PRDX1 (in red, same place). Credit: Sara Sdelci, CRG
In crisis, the nucleus calls antioxidant enzymes to the rescue. The nucleus being metabolically active is a profound paradigm shift with implications for cancer research.
Cells are thought to delicately balance their energy needs and avoid damaging DNA by containing metabolic activity outside the nucleus and within the cytoplasm and mitochondria. Antioxidant enzymes are deployed to mop up reactive oxygen species at their source before they reach DNA, a defensive strategy that protects the roughly 3 billion nucleotides from suffering potentially catastrophic mutations. If DNA damage occurs anyway, cells pause momentarily and carry out repairs, synthesising new building blocks and filling in the gaps.
Despite the central role of cellular metabolism in maintaining genome integrity, there has been no systematic, unbiased study on how metabolic perturbations affect the DNA damage and repair process. This is particularly important for diseases like cancer, characterised by their ability to hijack metabolic processes for unfettered growth.
A research team led by Sara Sdelci at the Centre for Genomic Regulation (CRG) in Barcelona and Joanna Loizou at the CeMM Research Center for Molecular Medicine of the Austrian Academy of Sciences in Vienna and the Medical University of Vienna addressed this challenge by carrying out various experiments to identify which metabolic enzymes and processes are essential for a cell’s DNA damage response. The findings are published today in the journal Molecular Systems Biology.
The researchers experimentally induced DNA damage in human cell lines using a common chemotherapy medication known as etoposide. Etoposide works by breaking DNA strands and blocking an enzyme which helps repair the damage. Surprisingly, inducing DNA damage resulted in reactive oxygen species being generated and accumulating inside the nucleus. The researchers observed that cellular respiratory enzymes, a major source of reactive oxygen species, relocated from the mitochondria to the nucleus in response to DNA damage.
The findings represent a paradigm shift in cellular biology because it suggests the nucleus is metabolically active.
“Where there’s smoke there’s fire, and where there’s reactive oxygen species there are metabolic enzymes at work. Historically, we’ve thought of the nucleus as a metabolically inert organelle that imports all its needs from the cytoplasm, but our study demonstrates that another type of metabolism exists in cells and is found in the nucleus,” says Dr. Sara Sdelci, corresponding author of the study and Group Leader at the Centre for Genomic Regulation.
The researchers also used CRISPR-Cas9 to identify all the metabolic genes that were important for cell survival in this scenario. These experiments revealed that cells order the enzyme PRDX1, an antioxidant enzyme also normally found in mitochondria, to travel to the nucleus and scavenge reactive oxygen species present to prevent further damage. PRDX1 was also found to repair the damage by regulating the cellular availability of aspartate, a raw material that is critical for synthesising nucleotides, the building blocks of DNA.
“PRDX1 is like a robotic pool cleaner. Cells are known to use it to keep their insides ‘clean’ and prevent the accumulation of reactive oxygen species, but never before at the nuclear level. This is evidence that, in a state of crisis, the nucleus responds by appropriating mitochondrial machinery and establishes an emergency rapid-industrialisation policy,” says Dr. Sdelci.
The findings can guide future lines of cancer research. Some anti-cancer drugs, such as etoposide used in this study, kill tumour cells by damaging their DNA and inhibiting the repair process. If enough damage accumulates, the cancer cell initiates a process where it autodestructs.
During their experiments, the researchers found that knocking out metabolic genes critical for cellular respiration – the process that generates energy from oxygen and nutrients – made normal healthy cells become resistant to etoposide. The finding is important because many cancer cells are glycolytic, meaning that even in the presence of oxygen they generate energy without doing cellular respiration. This means etoposide, and other chemotherapies with a similar mechanism, is likely to have a limited effect in treating glycolytic tumours.
The authors of the study call for the exploration of new strategies such as dual treatment combining etoposide with drugs that also boost the generation of reactive oxygen species to overcome drug resistance and kill cancer cells faster. They also hypothesise that combining etoposide with inhibitors of nucleotide synthesis processes could potentiate the effect of the drug by preventing the repair of DNA damage and ensuring cancer cells self-destruct correctly.
Dr. Joanna Loizou, corresponding author and Group Leader at the Centre for Molecular Medicine and the Medical University of Vienna, highlights the value of taking data-driven approaches to uncover new biological processes. ‘By using unbiased technologies such as CRISPR-Cas9 screening and metabolomics, we have learnt about how the two fundamental cellular processes of DNA repair and metabolism are intertwined. Our findings shed light on how targeting these two pathways in cancer might improve therapeutic outcomes for patients’.
Reference: Moretton et al. “A metabolic map of the DNA damage response identifies PRDX1 in the control of nuclear ROS scavenging and aspartate availability”, Molecular Systems Biology (2023). https://doi.org/10.15252/msb.202211267 URL after publication: https://www.embopress.org/doi/10.15252/msb.202211267
ESPAÑOL
Enzimas antioxidantes reparan el daño en el ADN
En situación de crisis, el núcleo celular llama a las enzimas antioxidantes al rescate. El hecho de que el núcleo sea metabólicamente activo es un profundo cambio de paradigma con implicaciones para la investigación del cáncer.
Una célula humana típica es metabólicamente activa, con un bullicio de reacciones químicas que convierten los nutrientes en energía y productos útiles que sustentan la vida. Estas reacciones también crean especies reactivas de oxígeno, subproductos peligrosos como el peróxido de hidrógeno que dañan los bloques de construcción del ADN de la misma manera que el oxígeno y el agua corroen el metal y forman óxido. Así como los edificios colapsan por el efecto acumulativo de la oxidación, las especies reactivas de oxígeno amenazan la integridad de un genoma.
Se cree que las células equilibran delicadamente sus necesidades energéticas y evitan dañar el ADN al contener la actividad metabólica fuera del núcleo y dentro del citoplasma y las mitocondrias. Las enzimas antioxidantes se despliegan para limpiar las especies reactivas de oxígeno en su origen antes de que lleguen al ADN, una estrategia defensiva que protege a los aproximadamente 3 mil millones de nucleótidos de sufrir mutaciones potencialmente catastróficas. Si el daño del ADN ocurre de todos modos, las células se detienen momentáneamente y llevan a cabo reparaciones, sintetizando nuevos bloques de construcción y llenando los vacíos.
A pesar del papel central del metabolismo celular en el mantenimiento de la integridad del genoma, no ha habido ningún estudio sistemático e imparcial sobre cómo las perturbaciones metabólicas afectan el daño del ADN y el proceso de reparación. Esto es particularmente importante para enfermedades como el cáncer, caracterizadas por su capacidad para apropiarse de procesos metabólicos para proliferar sin restricciones.
Un equipo de investigación dirigido por Sara Sdelci en el Centro de Regulación Genómica (CRG), en Barcelona, y Joanna Loizou en el CeMM Centro de Investigación de Medicina Molecular de la Academia Austriaca de Ciencias en Viena y la Universidad Médica de Viena abordaron este desafío llevando a cabo varios experimentos para identificar qué enzimas y procesos metabólicos son esenciales para la respuesta al daño del ADN de una célula. Los hallazgos se publican hoy en la revista Molecular Systems Biology.
Los investigadores indujeron experimentalmente daño en el ADN en líneas celulares humanas utilizando un fármaco de quimioterapia común conocido como etopósido. El etopósido funciona rompiendo las hebras de ADN y bloqueando una enzima que ayuda a reparar el daño. Sorprendentemente, la inducción de daño en el ADN resultó en la generación de especies reactivas de oxígeno y la acumulación dentro del núcleo. Los investigadores observaron que las enzimas respiratorias celulares, una fuente importante de especies reactivas de oxígeno, se trasladaron de las mitocondrias al núcleo en respuesta al daño del ADN.
Los hallazgos representan un cambio de paradigma en la biología celular porque sugiere que el núcleo es metabólicamente activo.
"Donde hay humo hay fuego, y donde hay especies reactivas de oxígeno hay enzimas metabólicas en funcionamiento. Históricamente, hemos pensado en el núcleo como un orgánulo metabólicamente inerte que importa todas sus necesidades del citoplasma, pero nuestro estudio demuestra que existe otro tipo de metabolismo en las células y se encuentra en el núcleo", dice la Dra. Sara Sdelci, autora del estudio y líder de grupo en el Centro de Regulación Genómica.
Los investigadores también utilizaron CRISPR-Cas9 para identificar todos los genes metabólicos que eran importantes para la supervivencia celular en este escenario. Estos experimentos revelaron que las células ordenan a la enzima PRDX1, una enzima antioxidante que también se encuentra normalmente en las mitocondrias, que viaje al núcleo y elimine las especies reactivas de oxígeno presentes para evitar daños mayores. También se encontró que PRDX1 repara el daño al regular la disponibilidad celular de aspartato, una materia prima que es crítica para la síntesis de nucleótidos, los bloques de construcción del ADN.
"PRDX1 es como un robot limpiador de piscinas. Se sabe que las células lo usan para mantener su interior "limpio" y evitar la acumulación de especies reactivas de oxígeno, pero nunca antes a nivel nuclear. Esto prueba que, en un estado de crisis, el núcleo responde apropiándose de la maquinaria mitocondrial y establece una política de rápida industrialización de emergencia", dice la Dra. Sdelci.
Los hallazgos pueden guiar futuras líneas de investigación del cáncer. Algunos fármacos contra el cáncer, como el etopósido utilizado en este estudio, matan las células tumorales al dañar su ADN e inhibir el proceso de reparación. Si se acumula suficiente daño, la célula cancerosa inicia un proceso en el que se autodestruye.
Durante sus experimentos, los investigadores encontraron que la eliminación de genes metabólicos críticos para la respiración celular, el proceso que genera energía a partir de oxígeno y nutrientes, hizo que las células sanas normales se volvieran resistentes al etopósido. El hallazgo es importante porque muchas células cancerosas son glicolíticas, lo que significa que incluso en presencia de oxígeno generan energía sin producir respiración celular. Esto significa que es probable que el etopósido, y otras quimioterapias con un mecanismo similar, tengan un efecto limitado en el tratamiento de tumores glicolíticos.
Los autores del estudio hacen un llamamiento para la exploración de nuevas estrategias, como el tratamiento dual que combina etopósido con fármacos que también aumentan la generación de especies reactivas de oxígeno para superar la resistencia a los fármacos y matar las células cancerosas más rápido. También plantean la hipótesis de que la combinación de etopósido con inhibidores de los procesos de síntesis de nucleótidos podría potenciar el efecto del fármaco al prevenir la reparación del daño del ADN y garantizar que las células cancerosas se autodestruyan correctamente.
Joanna Loizou, co-autora y líder de grupo en el Centro de Medicina Molecular y la Universidad Médica de Viena, destaca el valor de adoptar enfoques basados en datos para descubrir nuevos procesos biológicos. "Mediante el uso de tecnologías imparciales como la detección de CRISPR-Cas9 y la metabolómica, hemos aprendido cómo se entrelazan los dos procesos celulares fundamentales de la reparación del ADN y el metabolismo. Nuestros hallazgos arrojan luz sobre cómo abordar estas dos vías en el cáncer podría mejorar los resultados terapéuticos para los pacientes".
Referencia: Moretton et al. “A metabolic map of the DNA damage response identifies PRDX1 in the control of nuclear ROS scavenging and aspartate availability”, Molecular Systems Biology (2023). https://doi.org/10.15252/msb.202211267 URL after publication: https://www.embopress.org/doi/10.15252/msb.202211267
CATALÀ
Enzims antioxidants reparen el dany a l'ADN
En situació de crisi, el nucli cel·lular crida els enzims antioxidants al rescat. El fet que el nucli sigui metabòlicament actiu és un profund canvi de paradigma amb implicacions per a la investigació del càncer.
Una cèl·lula humana típica és metabòlicament activa, amb un bullici de reaccions químiques que converteixen els nutrients en energia i productes útils que sustenten la vida. Aquestes reaccions també creen espècies reactives d'oxigen, subproductes perillosos com el peròxid d'hidrogen que malmeten els blocs de construcció de l'ADN de la mateixa manera que l'oxigen i l'aigua corroeixen el metall i formen òxid. Així com els edificis col·lapsen per l'efecte acumulatiu de l'oxidació, les espècies reactives d'oxigen amenacen la integritat d'un genoma.
Es creu que les cèl·lules equilibren delicadament les seves necessitats energètiques i eviten danyar l'ADN en contenir l’activitat metabòlica fora del nucli i dins del citoplasma i les mitocòndries. Els enzims antioxidants es despleguen per netejar les espècies reactives d'oxigen en el seu origen abans que arribin a l'ADN, una estratègia defensiva que protegeix els aproximadament 3 mil milions de nucleòtids de patir mutacions potencialment catastròfiques. Si el dany de l'ADN passa de tota manera, les cèl·lules s'aturen momentàniament i duen a terme reparacions, sintetitzant nous blocs de construcció i omplint els buits.
Malgrat el paper central del metabolisme cel·lular en el manteniment de la integritat del genoma, no hi ha hagut cap estudi sistemàtic i imparcial sobre com les pertorbacions metabòliques afecten el dany de l'ADN i el procés de reparació. Això és particularment important per a malalties com el càncer, caracteritzades per la seva capacitat per apropiar-se de processos metabòlics per proliferar sense restriccions.
Un equip de recerca dirigit per Sara Sdelci al Centre de Regulació Genòmica (CRG), a Barcelona, i Joanna Loizou al CeMM Centre de Recerca de Medicina Molecular de l'Acadèmia Austríaca de Ciències a Viena i la Universitat Mèdica de Viena van abordar aquest desafiament duent a terme diversos experiments per identificar quins enzims i processos metabòlics són essencials per a la resposta al dany de l'ADN d'una cèl·lula. Les troballes es publiquen avui a la revista Molecular Systems Biology.
Els investigadors van induir experimentalment dany en l'ADN en línies cel·lulars humanes utilitzant un fàrmac de quimioteràpia comuna conegut com a etopòsid. L'etopòsid funciona trencant les fibres d'ADN i bloquejant un enzim que ajuda a reparar el dany. Sorprenentment, la inducció de dany en l'ADN va resultar en la generació d'espècies reactives d'oxigen i l'acumulació dins del nucli. Els investigadors van observar que els enzims respiratoris cel·lulars, una font important d'espècies reactives d'oxigen, es van traslladar de les mitocòndries al nucli en resposta al dany de l'ADN.
Les troballes representen un canvi de paradigma en la biologia cel·lular perquè suggereix que el nucli és metabòlicament actiu.
"On hi ha fum hi ha foc, i on hi ha espècies reactives d'oxigen hi ha enzims metabòlics en funcionament. Històricament, hem pensat en el nucli com un orgànul metabòlicament inert que importa totes les seves necessitats del citoplasma, però el nostre estudi demostra que existeix un altre tipus de metabolisme a les cèl·lules i es troba al nucli", diu la Dra. Sara Sdelci, autora de l’estudi i cap de grup al Centre de Regulació Genòmica.
Els investigadors també van utilitzar CRISPR-Cas9 per identificar tots els gens metabòlics que eren importants per a la supervivència cel·lular en aquest escenari. Aquests experiments van revelar que les cèl·lules ordenen a l'enzim PRDX1, un enzim antioxidant que també es troba normalment en les mitocòndries, que viatgi al nucli i elimini les espècies reactives d'oxigen presents per evitar danys majors. També es va trobar que PRDX1 repara el dany en regular la disponibilitat cel·lular d'aspartat, una matèria primera que és crítica per a la síntesi de nucleòtids, els blocs de construcció de l'ADN.
"PRDX1 és com un robot netejador de piscines. Se sap que les cèl·lules el fan servir per mantenir el seu interior "net" i evitar l'acumulació d'espècies reactives d'oxigen, però mai abans a nivell nuclear. Això prova que, en un estat de crisi, el nucli respon apropiant-se de la maquinària mitocondrial i estableix una política de ràpida industrialització d'emergència", diu la Dra. Sdelci.
Les troballes poden guiar futures línies d'investigació del càncer. Alguns fàrmacs contra el càncer, com l'etopòsid utilitzat en aquest estudi, maten les cèl·lules tumorals en danyar el seu ADN i inhibir el procés de reparació. Si s'acumula prou dany, la cèl·lula cancerosa inicia un procés en què s'autodestrueix.
Durant els seus experiments, els investigadors van trobar que l'eliminació de gens metabòlics crítics per a la respiració cel·lular, el procés que genera energia a partir d'oxigen i nutrients, va fer que les cèl·lules sanes normals es tornessin resistents a l'etopòsid. La troballa és important perquè moltes cèl·lules canceroses són glicolítiques, cosa que significa que fins i tot en presència d'oxigen generen energia sense produir respiració cel·lular. Això significa que és probable que l'etopòsid, i altres quimioteràpies amb un mecanisme similar, tinguin un efecte limitat en el tractament de tumors glicolítics.
Els autors de l'estudi fan una crida per a l'exploració de noves estratègies, com el tractament dual que combina etopòsid amb fàrmacs que també augmenten la generació d'espècies reactives d'oxigen per superar la resistència als fàrmacs i matar les cèl·lules canceroses més ràpid. També plantegen la hipòtesi que la combinació d'etopòsid amb inhibidors dels processos de síntesi de nucleòtids podria potenciar l'efecte del fàrmac en prevenir la reparació del dany de l'ADN i garantir que les cèl·lules canceroses s'autodestrueixin correctament.
Joanna Loizou, co-autora i cap de grup al Centre de Medicina Molecular i la Universitat Mèdica de Viena, destaca el valor d'adoptar enfocaments basats en dades per descobrir nous processos biològics. "Mitjançant l'ús de tecnologies imparcials com la detecció de CRISPR-Cas9 i la metabolòmica, hem après com s'entrellacen els dos processos cel·lulars fonamentals de la reparació de l'ADN i el metabolisme. Les nostres troballes aboquen llum sobre com abordar aquestes dues vies en el càncer podria millorar els resultats terapèutics per als pacients".
Referència: Moretton et al. “A metabolic map of the DNA damage response identifies PRDX1 in the control of nuclear ROS scavenging and aspartate availability”, Molecular Systems Biology (2023). https://doi.org/10.15252/msb.202211267 URL after publication: https://www.embopress.org/doi/10.15252/msb.202211267