NOTICIAS
NOTICIAS
‘Tiny but mighty’ gene fragments are crucial for maintaining blood sugar levels
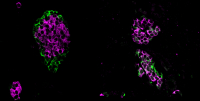
The image shows pancreatic islets in mice, specialised tissues that host beta cells. On the left, a healthy pancreatic islet is shown with its typical morphology with alpha cells in the periphery and beta cells in the core of the islet. On the right, mice with a mutation in Srrm3 that knock out the cells’ ability to regulate microexon inclusion results in islets with altered morphology and cell identity. This and other functional alterations ultimately impacts on the release of insulin and the ability to control blood glucose levels. Credit: Jonas Juan Mateu/CRG
When cells copy DNA to produce RNA transcripts, they include only some chunks of genetic material known as exons and throw out the rest. The resulting product is a fully-mature RNA molecule, which might then be used as a template to build a protein.
One of the features of gene expression is that, through a process known as alternative splicing, a cell can select different combinations of exons to make different RNA transcripts. Like movie producers creating a regular and director’s cut of a film, including or excluding a single exon can result in the production of proteins with different functions.
Living organisms use alternative splicing to enable complex functions. Different types of cells in different kinds of tissues produce different RNA transcripts from the same gene. Understanding how this process works provides new clues about human development, health and disease and paves the way for new diagnostic and therapeutic targets.
In recent years, researchers have discovered a type of protein-coding DNA sequences known as microexons. At just three to 27 nucleotides long, microexons are much shorter than the average exon, the average size of which is around 150 nucleotides. The existence of microexons across many different species ranging from flies to mammals suggest they have an important function because they have been conserved by natural selection for hundreds of millions of years.
In humans, most microexons are exclusively found in neuronal cells, where the tiny fragments exert a mighty role. For example, recent studies show that they are crucial for the development of photoreceptors, a specialised type of neuron in the retina. Research has also shown that alterations to microexon activity are common in autistic brains, suggesting that the tiny gene fragments play an important role in the clinical characteristics of the condition.
“A microexon is a short fragment of DNA that codes for a few amino acids, the building blocks of proteins. Though we don’t know the exact mechanisms of action involved, including or excluding just a handful of these amino acids during splicing sculpts the surfaces of proteins in a highly precise manner. Therefore, microexon splicing can be seen as a way to perform microsurgery of proteins in the nervous system, modifying how they interact with other molecules in the highly specialized synapses of neurons,” explains ICREA Research Professor Dr. Manuel Irimia, a researcher at the Centre for Genomic Regulation (CRG) who explores the functional role of microexons.
A research team led by Dr. Irimia and ICREA Research Professor Juan Valcárcel at the CRG has now discovered that microexons are also found in another type of cell that carries out highly-specialised functions within complex tissues and organs – endocrine cells in the pancreas. Microexon splicing is prevalent in pancreatic islets, tissues that host beta cells which make the hormone insulin. The findings are published today in the journal Nature Metabolism.
The researchers came across the discovery while they were studying the role of alternative splicing in the biology of pancreatic islets and maintenance of blood sugar levels. They studied RNA sequence data from different human and rodent tissues, specifically looking for exons that are differentially spliced in pancreatic islets compared to other tissues.
The data revealed that half the exons specifically enriched in pancreatic islets were microexons, almost all of which were also found in neuronal cells. The finding is in line with the idea that pancreatic islet cells have evolved by borrowing regulatory mechanisms from neuronal cells.
From the more than one hundred pancreatic islet microexons found, the majority were located on genes critical for insulin secretion or linked to type-2 diabetes risk. The research also revealed that microexon inclusion in RNA transcripts was controlled by SRRM3, a protein that binds to RNA molecules and is encoded by the SRRM3 gene. The authors of the study showed that high blood sugar levels induced both the expression of SRRM3 and the inclusion of microexons, hinting at the possibility that the regulation of microexon splicing could play a role in maintaining blood sugar levels.
To further understand the impact of islet microexons, the researchers carried out various functional experiments using human beta cells grown in the laboratory, as well as in vivo and ex vivo experiments with mice lacking the SRRM3 gene.
They found that depleting SRRM3 or repressing single microexons lead to impaired insulin secretion in beta cells. In mice, alterations to microexon splicing changed the shape of pancreatic islets, ultimately impacting the release of insulin.
The researchers also teamed up with the Group of Dr. Jorge Ferrer, also at CRG, to study genetic and RNA transcript data from diabetic and non-diabetic individuals to explore possible links between microexons and human metabolic disorders. They found that genetic variants which affect microexon inclusion are linked to variations in fasting blood sugar levels and also type-2 diabetes risk. They also found that type-2 diabetes patients have lower levels of microexons in their pancreatic islets.
The findings of the study pave the way to explore new therapeutic strategies to treat diabetes by modulating splicing. “Here we show that islet microexons play important roles in islet function and glucose homeostasis, potentially contributing to type-2 diabetes predisposition. For this reason, microexons may represent ideal therapeutic targets to treat dysfunctional beta cells in type-2 diabetes,” explains Dr. Jonas Juan Mateu, first author of the study and postdoctoral researcher at the CRG.
“A wide range of splicing modulators are available to treat a variety of human diseases. When I first started studying splicing in pancreatic islets eight years ago, I wanted to find out whether existing splicing modulators could be repurposed for diabetes. I think we’re one step closer to that,” adds Dr. Juan Mateu.
While the work shows microexons are important new players in pancreatic islet biology, further work will be needed to determine their precise impact during the tissue’s development. Researchers also lack mechanistic insight on how each individual microexon alters protein function and affects key pathways in islet cells. Understanding this will shed light on their exact physiological role in diabetes and other metabolic diseases linked to pancreatic islets.
The study adds to a growing body of evidence that microexons play crucial roles in human development, health and disease. "Less than 10 years after we first reported on their existence, we are seeing how microexons are key elements that modify how proteins interact with each other in cells with functions that require a high degree of specialization, such as neurotransmitter or insulin release and light transduction,” explains Dr. Irimia.
“Consequently, we expect mutations in microexons to lead to diseases whose genetic causes we have not yet understood. We are beginning to search for these mutations in patients with neurodevelopmental and metabolic disorders as well as retinopathies, to then devise possible interventions to treat them,” he concludes.
The findings were made by a team led by ICREA Research Professors Manuel Irimia and Juan Valcárcel, Group Leaders in the Systems and Synthetic Biology and Genome Biology research programmes, respectively. Collaborators include Dr. Jorge Ferrer, Coordinator of the Computational Biology and Health Genomics programme and Group Leader at CIBERDEM.
The findings were supported through a Health Research grant from the “La Caixa” Foundation, the European Research Council (ERC), the EU Marie Skłodowska-Curie European Postdoctoral Fellowships,the European Foundation for the Study of Diabetes (EFSD) and Lilly European Diabetes Research Programme.
EN CASTELLANO
Los "pequeños pero poderosos" fragmentos genéticos que mantienen los niveles de glucosa en la sangre
Cuando las células copian el ADN para producir transcripciones de ARN, incluyen solo algunos trozos de material genético conocidos como exones y tiran el resto a la basura. El producto que resulta es una molécula madura de ARN, que luego podría usarse como plantilla para construir una proteína.
Una de las características de la expresión génica es que, a través de un proceso conocido como 'alternative splicing’ en inglés, una célula puede seleccionar diferentes combinaciones de exones para hacer diferentes transcripciones de ARN. Al igual que los productores de cine, que crean la versión estándar de la película y la versión del director, la inclusión o exclusión de un solo exón puede resultar en la producción de proteínas con diferentes funciones.
Los seres vivos utilizan el splicing para permitir funciones complejas. Diferentes tipos de células en diferentes tipos de tejidos producen diferentes transcripciones de ARN a partir del mismo gen. Comprender cómo funciona este proceso proporciona nuevas pistas sobre el desarrollo humano, la salud y la enfermedad y allana el camino para el desarrollo de nuevos diagnósticos y terapias.
En los últimos años, se ha descubierto un tipo de secuencia de ADN que codifica proteínas - los microexones. Con solo una longitud que oscila entre los tres y los 27 nucleótidos, los microexones son mucho más cortos que otros exones, cuyo tamaño promedio es de alrededor de 150 nucleótidos. La existencia de microexones en muchas especies diferentes, desde moscas hasta mamíferos, sugiere que tienen una función importante porque han sido conservados por la selección natural durante cientos de millones de años.
En los seres humanos, la mayoría de los microexones se encuentran exclusivamente en las células neuronales, donde los pequeños fragmentos ejercen un gran poder. Por ejemplo, estudios recientes muestran que son cruciales para el desarrollo de fotorreceptores, un tipo de neurona en la retina. También se ha demostrado que las alteraciones en la actividad de los microexones son comunes en los cerebros de personas con autismo, lo que sugiere que los pequeños fragmentos de genes juegan un papel importante en las características clínicas de esta condición.
"Un microexón es un fragmento corto de ADN que codifica unos pocos aminoácidos, los componentes básicos de las proteínas. Aunque no conocemos los mecanismos de acción exactos, la inclusión o exclusión de solo un puñado de estos aminoácidos durante el splicing esculpe las superficies de las proteínas de una manera altamente precisa. Por lo tanto, el splicing de los microexones puede verse como una forma de realizar microcirugía en las proteínas del sistema nervioso, modificando la forma en que interactúan con otras moléculas en las sinapsis altamente especializadas de las neuronas", explica el profesor de investigación ICREA Dr. Manuel Irimia, investigador del Centro de Regulación Genómica (CRG) que explora el papel funcional de los microexones.
Conjuntamente con el profesor de investigación ICREA Dr. Juan Valcárcel, también en el CRG, el Dr. Irimia ha descubierto que los microexones también se encuentran en otro tipo de célula que lleva a cabo funciones altamente especializadas dentro de tejidos y órganos complejos: las células endocrinas en el páncreas. El splicing de microexones ocurre con frecuencia en los islotes pancreáticos, tejidos que albergan células beta que producen la hormona insulina. Los hallazgos se publican hoy en la revista Nature Metabolism.
El descubrimiento se llevó a cabo mientras el equipo estudiaba el papel del splicing en la biología de los islotes pancreáticos y el mantenimiento de los niveles de glucosa en la sangre. Estudiaron datos de secuencias de ARN de diferentes tejidos humanos y de roedores, buscando diferencias en el splicing de exones en los islotes pancreáticos en comparación con otros tejidos.
La mitad de los exones específicamente enriquecidos en los islotes pancreáticos eran microexones, casi todos los cuales también existen en las células neuronales. El hallazgo está en línea con la idea de que las células de los islotes pancreáticos han evolucionado tomando prestados mecanismos reguladores de las células neuronales.
De los más de cien microexones de islotes pancreáticos encontrados, la mayoría se localizaron en genes críticos para la secreción de insulina o relacionados con el riesgo de padecer diabetes tipo 2. La inclusión de los microexones está controlada por SRRM3, una proteína que funciona uniéndose a las moléculas de ARN y que está codificada por el gen SRRM3.
Los autores del estudio mostraron que los niveles altos de glucosa en la sangre indujeron tanto la expresión de SRRM3 como la inclusión de microexones, lo que sugiere la posibilidad de que la regulación del splicing de microexones podría desempeñar un papel en el mantenimiento de los niveles de glucosa en la sangre.
Para comprender mejor el impacto de los microexones de los islotes, llevaron a cabo varios experimentos funcionales utilizando células beta humanas cultivadas en el laboratorio, así como experimentos in vivo y ex vivo con ratones que carecen del gen SRRM3.
Descubrieron que el agotamiento de SRRM3 o la represión de microexones individuales alteran la secreción de la insulina en las células beta. En ratones, las alteraciones en el splicing de los microexones cambian la forma de los islotes pancreáticos, lo que finalmente afecta a la liberación de insulina.
El equipo científico también trabajó conjuntamente con el grupo del Dr. Jorge Ferrer, en el CRG, para estudiar datos genéticos y de transcripción de ARN procedentes de individuos con y sin diabetes, y explorar así posibles vínculos entre los microexones y los trastornos metabólicos humanos. Encontraron que las variantes genéticas que afectan la inclusión de microexones están relacionadas con variaciones en los niveles de glucosa en sangre en ayunas y también con el riesgo de padecer diabetes tipo 2. También encontraron que los pacientes con diabetes tipo 2 tienen niveles más bajos de microexones en sus islotes pancreáticos.
Los hallazgos allanan el camino para explorar nuevas estrategias terapéuticas para tratar la diabetes mediante la modulación del splicing. "Mostramos que los microexones de los islotes juegan un papel importante en la función de los islotes y el mantenimiento de la glucosa, lo que podría contribuir a la predisposición a la diabetes tipo 2. Por esta razón, los microexones pueden constituir dianas terapéuticas novedosas para tratar las células beta disfuncionales en la diabetes tipo 2", explica el Dr. Jonas Juan Mateu, primer autor del estudio e investigador postdoctoral en el CRG.
"Ya existe una amplia gama de moduladores de splicing, disponible para tratar una variedad de enfermedades humanas. Cuando comencé a estudiar el splicing en islotes pancreáticos hace ocho años, quería averiguar si los moduladores de splicing existentes podrían reutilizarse para la diabetes. Creo que estamos un paso más cerca de eso", añade el Dr. Juan Mateu.
Aunque el trabajo muestra la importancia de los microexones en los islotes pancreáticos, la ciencia sigue sin determinar su impacto preciso durante el desarrollo del tejido. Falta información de los mecanismos que explican cómo cada microexón individual altera la función de la proteína y afecta las funciones claves en las células de los islotes. Comprender esto ayudará conocer el papel fisiológico exacto en la diabetes y otras enfermedades metabólicas relacionadas con los islotes pancreáticos.
El estudio se suma a una creciente evidencia que muestra que los microexones desempeñan un papel crucial en el desarrollo humano, la salud y la enfermedad. "Menos de 10 años después de que informáramos por primera vez sobre su existencia, estamos viendo cómo los microexones son elementos clave que modifican la forma en que las proteínas interactúan entre sí en células con funciones que requieren un alto grado de especialización, como la liberación de neurotransmisores o insulina y la transducción de luz", explica el Dr. Irimia.
"En consecuencia, esperamos que las mutaciones en los microexones nos conduzcan a enfermedades cuyas causas genéticas aún no hemos entendido. Estamos empezando a buscar estas mutaciones en pacientes con trastornos del neurodesarrollo y metabólicos, así como retinopatías, para luego idear posibles intervenciones para tratarlas", concluye.
Los hallazgos fueron realizados por un equipo liderado por los profesores de investigación ICREA Manuel Irimia y Juan Valcárcel, jefes de grupo en los programas de Biología de Sistemas y Sintética, y Biología Genómica, respectivamente, en el CRG. Entre los colaboradores se incluye el Dr. Jorge Ferrer, coordinador del programa de Biología Computacional y Genómica de la Salud, y jefe de grupo en el CRG y el CIBERDEM.
La investigación ha contado con el apoyo de una ayuda de Investigación en Salud de la Fundación "la Caixa", el Consejo Europeo de Investigación (ERC), las becas posdoctorales Marie Sklodowska-Curie de la Unión Europea, la Fundación Europea para el Estudio de la Diabetes (EFSD) y el Programa Europeo de Investigación en Diabetes de Lilly.
EN CATALÀ
Els “petits però poderosos” fragments genètics que mantenen els nivells de glucosa a la sang
Quan les cèl·lules copien l’ADN per a produir transcripcions d’ARN, inclouen només alguns trossos de material genètic coneguts com a exons i llencen la resta a la brossa. El producte que resulta és una molècula madura d’ARN, que després podria emprar-se com a plantilla per a construir una proteïna.
Una de les característiques de l’expressió gènica és que, a través d’un procés conegut com a ‘alternative splicing’ en anglès, una cèl·lula pot seleccionar diferents combinacions d’exons per a fer diferents transcripcions d’ARN. Igual que els productors de cinema, que creen la versió estàndard de la pel·lícula i la versió del director, la inclusió o exclusió d’un sol exó pot resultar en la producció de proteïnes amb diferents funcions.
Els éssers vius utilitzen l’splicing per permetre funcions complexes. Diferents tipus de cèl·lules en diferents tipus de teixits produeixen diferents transcripcions d’ARN a partir del mateix gen. Comprendre com funciona aquest procés proporciona noves pistes sobre el desenvolupament humà, la salut i la malaltia i aplana el camí per al desenvolupament de nous diagnòstics i teràpies.
En els darrers anys, s’ha descobert un tipus de seqüència d’ADN que codifica proteïnes –els microexons. Amb només una longitud que oscil·la entre els 3 i els 27 nucleòtids, els microexons són molt més curts que d’altres exons, la mida mitjana dels quals és del voltant de 150 nucleòtids. L’existència de microexons en moltes espècies diferents, des de mosques fins a mamífers, suggereix que tenen una funció important perquè han estat conservats per la selecció natural durant centenars de milions d’anys.
En els éssers humans, la majoria de microexons es troben exclusivament en les cèl·lules neuronals, on els petits fragments exerceixen un gran poder. Per exemple, estudis recents mostren que són crucials per al desenvolupament de fotoreceptors, un tipus de neurona de la retina. També s’ha demostrat que les alteracions en l’activitat dels microexons són comunes en els cervells de persones amb autisme, fet que suggereix que els petits fragments de gens juguen un paper important en les característiques clíniques d’aquesta condició.
“Un microexó és un fragment curt d’ADN que codifica uns pocs aminoàcids, els components bàsics de les proteïnes. Tot i que no coneixem els mecanismes d’acció exactes, la inclusió o exclusió de només un grapat d’aquests aminoàcids durant l’splicing esculpeix les superfícies de les proteïnes d’una manera altament precisa. Per tant, l’splicing dels microexons es pot veure com una forma de realitzar microcirurgia en les proteïnes del sistema nerviós, modificant la forma en què interactuen amb d’altres molècules en les sinapsis altament especialitzades de les neurones”, explica el professor d’investigació ICREA Dr. Manuel Irimia, investigador del Centre de Regulació Genòmica (CRG), que explora el paper funcional dels microexons.
Conjuntament amb el professor d’investigació ICREA Dr. Juan Valcárcel, també al CRG, el Dr. Irimia ha descobert que els microexons també es troben en un altre tipus de cèl·lula que duu a terme funcions altament especialitzades dins de teixits i òrgans complexos: les cèl·lules endocrines al pàncrees. L’splicing de microexons succeeix amb freqüència en els illots pancreàtics, teixits que alberguen cèl·lules beta que produeixen l’hormona insulina. Les troballes es publiquen avui a la revista Nature Metabolism.
El descobriment es dugué a terme mentre l’equip estudiava el paper de l’splicing en la biologia dels illots pancreàtics i el manteniment dels nivells de glucosa a la sang. Estudiaren dades de seqüències d’ARN de diferents teixits humans i de rosegadors, buscant diferències en l’splicing d’exons en els illots pancreàtics en comparació amb d’altres teixits.
La meitat dels exons específicament enriquits als illots pancreàtics eren microexons, la majoria dels quals també existeix a les cèl·lules neuronals. La troballa està en línia amb la idea que indica que les cèl·lules dels illots pancreàtics han evolucionat prenent prestats mecanismes reguladors de les cèl·lules neuronals.
Dels més de cent microexons d’illots pancreàtics trobats, la majoria es localitzaren en gens crítics per a la secreció d’insulina o relacionats amb el risc de patir diabetis tipus 2. La inclusió dels microexons està controlada per SRRM3, una proteïna que funciona unint-se a les molècules d’ARN i que està codificada pel gen SRRM3.
Els autors de l’estudi mostraren que els nivells alts de glucosa a la sang induïren tant l’expressió d’SRRM3 com la inclusió de microexons, fet que suggereix la possibilitat que la regulació de l’splicing de microexons podria exercir un paper en el manteniment dels nivells de glucosa a la sang.
Per a comprendre millor l’impacte dels microexons dels illots, dugueren a terme diversos experiments funcionals emprant cèl·lules beta humanes cultivades al laboratori, així com experiments in vivo i ex vivo amb ratolins mancats del gen SRRM3.
Descobriren que l’esgotament d’SRRM3 o la repressió de microexons individuals alteren la secreció de la insulina en les cèl·lules beta. En ratolins, les alteracions de l’splicing dels microexons canvien la forma dels illots pancreàtics, el que finalment afecta l’alliberament d’insulina.
L’equip científic també treballà conjuntament amb el grup del Dr. Jorge Ferrer, al CRG, per estudiar dades genètiques i de transcripció d’ARN procedents d’individus amb i sense diabetis, i explorar així possibles vincles entre els microexons i els trastorns metabòlics humans. Trobaren que les variants genètiques que afecten la inclusió de microexons estan relacionades amb variacions en els nivells de glucosa a la sang en dejú i també amb el risc de patir diabetis tipus 2. També trobaren que els pacients amb diabetis tipus 2 tenen nivells tenen nivells més baixos de microexons als seus illots pancreàtics.
Les troballes aplanen el camí per a explorar noves estratègies terapèutiques per tractar la diabetis mitjançant la modulació de l’splicing. “Mostrem que els microexons dels illots juguen un paper important en la funció dels illots i el manteniment de la glucosa, fet que podria contribuir a la predisposició a la diabetis tipus 2. Per aquesta raó, els microexons poden constituir dianes terapèutiques innovadores per tractar les cèl·lules beta disfuncionals a la diabetis tipus 2”, explica el Dr. Jonas Juan Mateu, primer autor de l’estudi i investigador postdoctoral al CRG.
“Ja existeix una àmplia gamma de moduladors d’splicing, disponible per tractar una varietat de malalties humanes. Quan vaig començar a estudiar l’splicing en illots pancreàtics fa vuit anys, volia esbrinar si els moduladors d’splicing existents podrien reutilitzar-se per a la diabetis. Crec que estem un pas més a prop d’això”, afegeix el Dr. Juan Mateu.
Tot i que el treball mostra la importància dels microexons en els illots pancreàtics, la ciència segueix sense determinar el seu impacte precís durant el desenvolupament del teixit. Falta informació dels mecanismes que expliquen com cada microexó individual altera la funció de la proteïna i afecta les funcions claus en les cèl·lules dels illots. Comprendre això ajudarà a conèixer el paper fisiològic exacte en la diabetis i d’altres malalties metabòliques relacionades amb els illots pancreàtics.
L’estudi se suma a una creixent evidència que mostra que els microexons exerceixen un paper crucial en el desenvolupament humà, la salut i la malaltia. “Menys de 10 anys després d’informar per primer cop sobre la seva existència, estem veient com els microexons són elements clau que modifiquen la forma en què les proteïnes interactuen entre elles en cèl·lules amb funcions que requereixen un alt grau d’especialització, com l’alliberament de neurotransmissors o insulina i la transducció de llum”, explica el Dr. Irimia.
“En conseqüència, esperem que les mutacions en els microexons ens condueixin a malalties les causes genètiques de les quals encara no hem entès. Estem començant a buscar aquestes mutacions en pacients amb trastorns del neurodesenvolupament i metabòlics, així com retinopaties, per després idear possibles intervencions per a tractar-les”, conclou.
Les troballes es realitzaren per part d’un equip liderat pels professors d’investigació ICREA Manuel Irimia i Juan Valcárcel, caps de grup en els programes de Biologia de Sistemes i Sintètica, i Biologia Genòmica, respectivament, al CRG. Entre els col·laboradors s’inclou el Dr. Jorge Ferrer, coordinador del programa de Biologia Computacional i Genòmica de la Salut, i cap de grup al CRG i al CIBERDEM.
La recerca ha comptat amb el suport d’un ajut de Recerca en Salut de la Fundació ‘la Caixa’, el Consell Europeu de Recerca (ERC), la Fundació Europea per a l’Estudi de la Diabetis (EFSD) i el Programa Europeu de Recerca en Diabetis de Lilly.