NOTICIAS
NOTICIAS
Secret Vulnerabilities of Cancer’s ‘Death Star’ Revealed
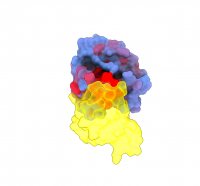
The human protein KRAS (blue) interacting with RAF1 (yellow), one of its main partners. The blue-to-red colour gradient indicates increasing potential for allosteric effects. Credit: Weng, Faure and Escobedo/Centro de Regulación Genómica
Researchers at the Centre for Genomic Regulation in Barcelona, Spain, and the Wellcome Sanger Institute near Cambridge, UK, have comprehensively identified the allosteric control sites found in the protein KRAS. These are highly sought after targets for drug development, representing secret vulnerabilities which can be exploited to control the effects of one of the most important causes of cancer. The study presents the first complete control map for any protein and is published today in the journal Nature.
KRAS is one of the most frequently mutated genes in cancers of many types. It is found in 1 in 10 human cancers, with higher prevalence in deadly types such as pancreatic or lung cancers. It has been called the ‘Death Star’ protein because of its spherical shape and lack of a good site to target with drugs. For this reason, KRAS has been historically considered ‘undruggable’ since it was first discovered in 1982.
The only effective strategy to control KRAS has been by targeting its allostery communication system. These are molecular signals which work through a remote-control lock and key mechanism. To control a protein, you need a key (a chemical compound or drug) that can open a lock (active site). Proteins can also be influenced by a secondary lock (allosteric site) which lies elsewhere on its surface. When a molecule binds to an allosteric site, it causes a change in the protein's shape, which can alter the protein's activity or its ability to bind to other molecules, for example by changing the internal structure of its main lock.
Allosteric sites are often preferred for drug development as they offer greater specificity, reducing the likelihood of side effects. They can also change a protein's activity more subtly, offering potential for fine-tuning its function. Drugs that target allosteric sites are generally safer and more effective compared to drugs targeting active sites.
However, allosteric sites are highly elusive. Despite four decades of research, tens of thousands of scientific publications, and more than three hundred published structures of KRAS, only two drugs have been approved for clinical use - sotorasib and adagrasib. The drugs work by attaching to a pocket adjacent to the active site, inducing an allosteric conformational change in the protein that prevents it from being activated.
“It took decades to produce a working drug against KRAS partly because we lacked tools to identify allosteric sites at scale, meaning we were looking for therapeutic target sites in the dark. In this study we demonstrate a new approach that can map allosteric sites systematically for entire proteins. For the purposes of drug discovery, it’s like turning the lights on and laying bare the many ways we can control a protein,” explains Dr. André Faure, staff scientist at the Centre for Genomic Regulation and co-author of the study.
Four promising targets for safer, more effective drugs
The authors of the study mapped the allosteric sites by using a technique called deep mutational scanning. It involved creating over 26,000 variations of the KRAS protein, changing only one or two building blocks (amino acids) at a time. The team checked how these different KRAS variations bind to six other proteins, including those critical for KRAS to cause cancer. The researchers used AI software to analyse the data, detect allostery and identify the location of known and new therapeutic target sites.
"The unique selling point of our method is its scalability. In this work alone we made more than 22,000 biophysical measurements, a similar number as the total ever made for all proteins before we started harnessing the remarkable strides in DNA sequencing and synthesis methodologies. This is an enormous acceleration and demonstrates the power and potential of the approach,” explains Chenchun Weng, first author of the study and postdoctoral researcher at the Centre for Genomic Regulation.
The technique revealed that KRAS has many more strong allosteric sites than expected. Mutations in these sites inhibited the protein’s binding to all three of its main partners, suggesting that broadly inhibiting the activity of KRAS is possible. A subset of these sites are particularly interesting as they are located in four different pockets easily accessible on the surface of the protein, and represent promising targets for future drugs.
The authors of the study highlight one in particular – ‘pocket 3’ – as particularly interesting. This pocket is located far away from the active site of KRAS and so has previously received very little attention from pharmaceutical companies.
The researchers also found that small alterations in KRAS can drastically change its behaviour with its partners, making the protein prefer one over another. This has important implications because it could lead to new strategies which control the aberrant activity of KRAS without hampering its normal function in non-cancerous tissues. Sparing normal versions of KRAS means fewer side effects, and safer, more effective treatments. Researchers could also use this knowledge to dig further into the biology of KRAS and explain how the protein behaves in various scenarios, which could be key to determining its role in different cancer types.
New blueprint to drug the ‘undruggable’
The study provides the first ever complete map of allosteric sites for any complete protein in any species. The research shows that with the right tools and techniques, like the ones they used to map KRAS, new vulnerabilities can be uncovered for many different medically-important proteins that have historically been considered ‘undruggable’.
“The big challenge in medicine isn’t knowing which proteins are causing diseases but not knowing how to control them. Our study represents a new strategy to target these proteins and speed up the development of drugs to control their activity. The nature of targeting allosteric sites means that the resulting drugs are likely to be safer, more effective treatments than the ones we have right now,” concludes ICREA Research Professor Dr. Ben Lehner, senior author of the study from the Centre for Genomic Regulation and the Wellcome Sanger Institute.
EN CASTELLANO
Revelan las vulnerabilidades secretas de la 'Estrella de la Muerte' del cáncer
Un equipo del Centro de Regulación Genómica en Barcelona, España, y del Instituto Wellcome Sanger en Cambridge, Reino Unido, ha identificado de manera exhaustiva los sitios de control alostérico de la proteína KRAS. Dichos sitios representan dianas terapéuticas muy valiosas para el desarrollo de fármacos, ya que constituyen vulnerabilidades secretas que pueden ser utilizadas para controlar los efectos de una de las causas más importantes del cáncer. El estudio, que presenta el primer mapa de control completo obtenido hasta ahora para cualquier proteína, se publica hoy en la revista Nature.
KRAS es uno de los genes que más mutaciones sufre en cánceres de muchos tipos. Se encuentra en uno de cada diez cánceres humanos, con una mayor prevalencia en tipos severos como los de páncreas o pulmón. La proteína a la que da lugar se ha comparado con la 'Estrella de la Muerte' del universo ‘Star Wars’ por su forma esférica y su impenetrabilidad, ya que carece de un buen sitio en su superficie para ser regulada con fármacos. Por esta razón, KRAS ha sido históricamente considerada 'inabordable' desde su descubrimiento en 1982.
La única estrategia eficaz para controlar KRAS ha sido atacar su sistema de comunicación alostérico: señales moleculares que funcionan a través de un mecanismo de ‘control remoto’ de llave y cerradura. Para controlar una proteína, se necesita una llave (un compuesto químico o fármaco) que pueda abrir una cerradura (sitio activo). Las proteínas también pueden ser controladas por una cerradura secundaria (sitio alostérico) ubicada en otra parte de su superficie. Cuando una molécula se une a un sitio alostérico, provoca un cambio en la forma de la proteína, lo que puede alterar su actividad o su capacidad para unirse a otras moléculas, por ejemplo, cambiando la estructura interna de la cerradura principal.
Los sitios alostéricos se prefieren para el desarrollo de fármacos, ya que ofrecen mayor especificidad, reduciendo la probabilidad de efectos secundarios. También pueden cambiar la actividad de una proteína de manera más sutil, ofreciendo el potencial de ajustar su función con control inteligente. Los fármacos que se dirigen a sitios alostéricos suelen ser más seguros y efectivos en comparación con los fármacos que se dirigen a sitios activos.
Sin embargo, los sitios alostéricos son difíciles de detectar. Tras cuatro décadas de investigación, decenas de miles de publicaciones científicas y más de trescientas estructuras publicadas de KRAS, solo dos fármacos han sido aprobados para uso clínico: sotorasib y adagrasib. Los fármacos funcionan al unirse a una cavidad adyacente al sitio activo, induciendo un cambio conformacional alostérico en la proteína que impide su activación.
"Llevó décadas producir un fármaco efectivo contra KRAS, en parte porque nos faltaban herramientas para identificar sitios alostéricos a gran escala, lo que significa que estábamos buscando dianas terapéuticas diana a ciegas. En este estudio demostramos un nuevo enfoque para mapear sitios alostéricos sistemáticamente en proteínas enteras. Para el propósito de descubrir fármacos, es como encender las luces y exponer las muchas maneras en que podemos controlar una proteína", explica el Dr. André Faure, científico en el Centro de Regulación Genómica y coautor del estudio.
Cuatro nuevas dianas prometedoras para fármacos más seguros y efectivos
Los autores del estudio mapearon los sitios alostéricos utilizando una técnica llamada escaneo mutacional profundo. Crearon más de 26 mil variaciones de la proteína KRAS, cambiando solo uno o dos aminoácidos a la vez. El equipo verificó cómo estas diferentes variaciones de KRAS se unían a otras seis proteínas, incluyendo aquellas críticas para que KRAS provoque cáncer. Los investigadores utilizaron software de IA para analizar los datos, detectar alosterismo e identificar la ubicación de sitios terapéuticos conocidos y nuevos.
"El punto fuerte de nuestro método es su escalabilidad. En este trabajo hemos realizado más de 22 mil mediciones biofísicas, un número comparable con el total hecho para todas las proteínas antes de que se pudieran aprovechar los avances en metodologías de secuenciación y síntesis de ADN. Esto es una aceleración enorme y demuestra el poder y potencial de nuestro método", explica Chenchun Weng, primer autor del estudio e investigador postdoctoral en el Centro de Regulación Genómica.
La técnica ha mostrado que KRAS tiene muchos más sitios alostéricos de lo esperado. Las mutaciones en estos sitios inhiben interacciones esenciales para la función de KRAS, sugiriendo que es posible inhibir ampliamente su actividad. Algunos de estos sitios alostéricos son de particular interés, ya que se encuentran en cuatro cavidades diferentes, cada una fácilmente accesible en la superficie de la proteína, por lo cual representan dianas terapéuticas prometedoras para futuros fármacos. Los autores del estudio destacan una en particular, la 'cavidad 3', como particularmente interesante. Esta cavidad está ubicada lejos del sitio activo de KRAS y por lo tanto ha recibido muy poca atención por parte de las empresas farmacéuticas.
Los investigadores también encontraron que pequeñas alteraciones en KRAS pueden cambiar drásticamente sus interacciones, haciendo que la proteína prefiera unas más que otras. Esto tiene implicaciones importantes porque podría conducir al desarrollo de nuevas estrategias para controlar la actividad anormal de KRAS sin perjudicar su función normal en tejidos no cancerosos. Conservar las versiones normales de KRAS significa menos efectos secundarios y tratamientos más seguros y efectivos. Esta información también podría ser útil para explicar cómo se comporta KRAS en varios escenarios, lo cual podría ser clave para determinar su papel en diferentes tipos de cáncer.
Nuevo esquema para abordar lo 'inabordable'
El estudio proporciona el primer mapa completo de sitios alostéricos obtenido para una proteína completa. La investigación muestra que, con las herramientas y técnicas adecuadas, como las que se han usado para mapear KRAS, se pueden descubrir nuevas vulnerabilidades para modular muchas proteínas con relevancia clínica y que históricamente se han considerado 'inabordables'.
"El gran desafío en medicina no es saber qué proteínas provocan enfermedades, sino que desconocemos cómo controlarlas. Nuestro estudio representa una nueva estrategia para atacar estas proteínas y acelerar el desarrollo de fármacos para controlar su actividad. El hecho de dirigir fármacos a sitios alostéricos implica que probablemente serán más seguros y efectivos que los que tenemos ahora", concluye el Dr. Ben Lehner, profesor de investigación ICREA, autor principal del estudio del Centro de Regulación Genómica y el Instituto Wellcome Sanger.
Revelen les vulnerabilitats secretes de l''Estrella de la Mort' del càncer
Un equip del Centre de Regulació Genòmica a Barcelona i de l'Institut Wellcome Sanger a Cambridge ha identificat de manera exhaustiva els llocs de control al·lostèric de la proteïna KRAS. Aquests llocs representen dianes terapèutiques molt preuades per al desenvolupament de fàrmacs, ja que constitueixen vulnerabilitats secretes que poden ser utilitzades per controlar els efectes d'una de les causes més importants del càncer. L'estudi, que presenta el primer mapa de control complet obtingut fins ara per a qualsevol proteïna, es publica avui a la revista Nature.
KRAS és un dels gens que més mutacions pateix en càncers de molts tipus. Es troba en un de cada deu càncers humans, amb una major prevalença en tipus severs com els de pàncrees o pulmó. La proteïna a la qual dóna lloc s'ha comparat amb l''Estrella de la Mort' de l'univers ‘Star Wars’ per la seva forma esfèrica i la seva impenetrabilitat, ja que li manca un bon lloc a la seva superfície per ser regulada amb fàrmacs. Per aquesta raó, KRAS ha estat històricament considerada 'inabordable' des del seu descobriment el 1982.
L'única estratègia eficaç per controlar KRAS ha estat atacar el seu sistema de comunicació al·lostèric: senyals moleculars que funcionen a través d'un mecanisme de ‘control remot’ de clau i pany. Per controlar una proteïna, es necessita una clau (un compost químic o fàrmac) que pugui obrir un pany (lloc actiu). Les proteïnes també poden ser controlades per un pany secundari (lloc al·lostèric) ubicat en una altra part de la seva superfície. Quan una molècula s’uneix a un lloc al·lostèric, provoca un canvi en la forma de la proteïna, la qual cosa pot alterar la seva activitat o la seva capacitat per unir-se a d’altres molècules, per exemple, canviant l'estructura interna del pany principal.
Els llocs al·lostèrics es prefereixen per al desenvolupament de fàrmacs, ja que ofereixen una major especificitat, reduint la probabilitat d'efectes secundaris. També poden canviar l'activitat d'una proteïna de manera més subtil, oferint el potencial d’ajustar la seva funció amb control intel·ligent. Els fàrmacs que es dirigeixen a llocs al·lostèrics solen ser més segurs i efectius en comparació amb els fàrmacs que es dirigeixen a llocs actius.
Tanmateix, els llocs al·lostèrics són difícils de detectar. Després de quatre dècades de recerca, desenes de milers de publicacions científiques i més de tres-centes estructures publicades de KRAS, només dos fàrmacs han estat aprovats per a ús clínic: sotorasib i adagrasib. Els fàrmacs funcionen en unir-se a una cavitat adjacent al lloc actiu, induint un canvi conformacional al·lostèric en la proteïna que impedeix la seva activació.
"Es va trigar dècades a produir un fàrmac efectiu contra KRAS, en part perquè ens faltaven eines per identificar llocs al·lostèrics a gran escala, fet que significa que estàvem buscant dianes terapèutiques a cegues. En aquest estudi demostrem un nou enfocament per cartografiar llocs al·lostèrics sistemàticament en proteïnes senceres. Per al propòsit de descobrir fàrmacs, és com encendre els llums i exposar les moltes maneres en què podem controlar una proteïna", explica el Dr. André Faure, científic al Centre de Regulació Genòmica i coautor de l'estudi.
Quatre noves dianes prometedores per a fàrmacs més segurs i efectius
Els autors de l'estudi van cartografiar els llocs al·lostèrics utilitzant una tècnica anomenada escaneig mutacional profund. Van crear més de 26 mil variacions de la proteïna KRAS, canviant només un o dos aminoàcids cada vegada. L'equip va verificar com aquestes diferents variacions de KRAS s’unien a d’altres sis proteïnes, incloent aquelles crítiques per a que KRAS provoqui càncer. Els investigadors van utilitzar programari d'IA per analitzar les dades, detectar al·losterisme i identificar la ubicació de llocs terapèutics coneguts i nous.
"El punt fort del nostre mètode és la seva escalabilitat. En aquest treball hem fet més de 22 mil mesuraments biofísics, un nombre comparable amb el total fet per a totes les proteïnes abans que es poguessin aprofitar els avenços en metodologies de seqüenciació i síntesi d'ADN. Això és una acceleració enorme i demostra el poder i potencial del nostre mètode", explica Chenchun Weng, primer autor de l'estudi i investigador postdoctoral al Centre de Regulació Genòmica.
La tècnica ha mostrat que KRAS té molts més llocs al·lostèrics del que s'esperava. Les mutacions en aquests llocs inhibeixen interaccions essencials per a la funció de KRAS, suggerint que és possible inhibir àmpliament la seva activitat. Alguns d'aquests llocs al·lostèrics són de particular interès, ja que es troben en quatre cavitats diferents, cadascuna fàcilment accessible a la superfície de la proteïna, pel qual representen dianes terapèutiques prometedores per a futurs fàrmacs. Els autors de l'estudi en destaquen una en particular, la'cavitat 3', com a particularment interessant. Aquesta cavitat està ubicada lluny del lloc actiu de KRAS i per tant ha rebut molt poca atenció per part de les empreses farmacèutiques.
Els investigadors també van trobar que petites alteracions en KRAS poden canviar dràsticament les seves interaccions, fent que la proteïna en prefereixi unes més que d’altres. Això té implicacions importants perquè podria conduir al desenvolupament de noves estratègies per tal de controlar l'activitat anormal de KRAS sense perjudicar la seva funció normal en teixits no cancerosos. Conservar les versions normals de KRAS significa menys efectes secundaris i tractaments més segurs i efectius. Aquesta informació també podria ser útil per explicar com es comporta KRAS en diversos escenaris, fet que podria ser clau per determinar el seu paper en diferents tipus de càncer.
Nou esquema per abordar allò 'inabordable'
L'estudi proporciona el primer mapa complet de llocs al·lostèrics obtingut per a una proteïna completa. La recerca mostra que, amb les eines i tècniques adequades, com les s’han utilitzat per cartografiar KRAS, es poden descobrir noves vulnerabilitats per a modular moltes proteïnes amb rellevància clínica i que històricament s'han considerat 'inabordables'.
"El gran desafiament en medicina no és saber quines proteïnes provoquen malalties, sinó que desconeixem com controlar-les. El nostre estudi representa una nova estratègia per atacar aquestes proteïnes i accelerar el desenvolupament de fàrmacs per controlar la seva activitat. El fet de dirigir fàrmacs a llocs al·lostèrics implica que els fàrmacs resultants probablement seran més segurs i efectius que els que tenim ara", conclou el Dr. Ben Lehner, professor d’investigació ICREA, autor principal de l'estudi del Centre de Regulació Genòmica i l'Institut Wellcome Sanger.