NOTICIAS
NOTICIAS
Researchers create ‘living medicine’ to treat drug-resistant infections
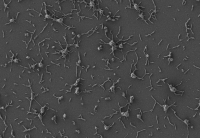
Mycoplasma pneumoniae cells, small bacteria that are naturally adapted to the human lung. Credit: María Lluch/CRG
Researchers at the Centre for Genomic Regulation (CRG) and Pulmobiotics S.L have created the first ‘living medicine’ to treat antibiotic-resistant bacteria growing on the surfaces of medical implants. The researchers created the treatment by removing a common bacteria’s ability to cause disease and repurposing it to attack harmful microbes instead.
The experimental treatment was tested on infected catheters in vitro, ex vivo and in vivo, successfully treating infections across all three testing methods. According to the authors, injecting the therapy under the skin of mice treated infections in 82% of the treated animals.
The findings are an important first step for the development of new treatments for infections affecting medical implants such as catheters, pacemakers and prosthetic joints. These are highly resistant to antibiotics and account for 80% of all infections acquired in hospital settings.
The study is published today in the journal Molecular Systems Biology. This work has been supported by the “la Caixa” Foundation through the CaixaResearch Health call, the European Research Council (ERC), the MycoSynVac project under the EU’s Horizon 2020 research and innovation programme, the Generalitat de Catalunya and the Instituto de Salud Carlos III.
The new treatment specifically targets biofilms, colonies of bacterial cells that stick together on a surface. The surfaces of medical implants are ideal growing conditions for biofilms, where they form impenetrable structures that prevent antibiotics or the human immune system from destroying the bacteria embedded within. Biofilm-associated bacteria can be a thousand times more resistant to antibiotics than free-floating bacteria.
Staphylococcus aureus is one of the most common species of biofilm-associated bacteria. S. aureus infections do not respond to conventional antibiotics, requiring patients to surgically remove any infected medical implants. Alternative therapies include the use of antibodies or enzymes, but these are broad-spectrum treatments that are highly toxic for normal tissues and cells, causing undesired side effects.
The authors of the study hypothesised that introducing living organisms that directly produce enzymes in the local vicinity of biofilms is a safer and cheaper way of treating infections. Bacteria are an ideal vector, as they have small genomes that can be modified using simple genetic manipulation.
The researchers chose to engineer Mycoplasma pneumoniae, a common species of bacteria that lacks a cell wall, making it easier to release the therapeutic molecules that fight infection while also assisting it in evading detection from the human immune system. Other advantages of using M. pneumoniae as a vector include its low risk of mutating new abilities, and its inability to transfer any of its modified genes to other microbes living nearby.
M. pneumoniae was first modified so that it would not cause illness. Further tweaks made it produce two different enzymes that dissolve biofilms and attacks the cell walls of the bacteria embedded within. The researchers also modified the bacteria so that it secretes antimicrobial enzymes more efficiently.
The researchers first aim to use the modified bacteria to treat biofilms building around breathing tubes, as M. pneumoniae is naturally adapted to the lung. “Our technology, based on synthetic biology and live biotherapeutics, has been designed to meet all safety and efficacy standards for application in the lung, with respiratory diseases being one of the first targets. Our next challenge is to address high-scale production and manufacturing, and we expect to start clinical trials in 2023,” says María Lluch, co-corresponding author of the study and Chief Science Officer of Pulmobiotics.
The modified bacteria may also have long-term applications for other diseases. “Bacteria are ideal vehicles for ‘living medicine’ because they can carry any given therapeutic protein to treat the source of a disease. One of the great benefits of the technology is that once they reach their destination, bacterial vectors offer continuous and localised production of the therapeutic molecule. Like any vehicle, our bacteria can be modified with different payloads that target different diseases, with potentially more applications in the future,” says ICREA Research Professor Luis Serrano, Director of the CRG and co-author of the study.
EN CASTELLANO
Un equipo científico crea una ‘píldora viva’ para tratar infecciones resistentes a los antibióticos
Un equipo científico en el Centro de Regulación Genómica (CRG) y Pulmobiotics S.L. ha creado la primera ‘píldora viva’ para tratar bacterias resistentes a los antibióticos que se expanden en las superficies de los implantes médicos. El equipo científico desarrolló el tratamiento eliminando una habilidad común de las bacterias que causa la enfermedad, transformándola para que ataque a los microbios perjudiciales.
El tratamiento experimental se probó en catéteres infectados in vitro, ex vivo e in vivo. Se trataron con éxito infecciones mediante los tres métodos de prueba. Según los autores, la inoculación de la terapia bajo la piel de los ratones acabó con las infecciones en el 82% de los animales tratados.
Estos hallazgos son un primer paso muy importante para el desarrollo de nuevos tratamientos de las infecciones que afectan a los implantes médicos, tales como catéteres, marcapasos e implantes prostéticos. Dichas infecciones son altamente resistentes a los antibióticos y son la causa del 80% de todas las infecciones contraídas en hospitales.
El estudio se publica hoy en la revista Molecular Systems Biology. Este trabajo ha recibido el apoyo de la Fundación ‘la Caixa’ a través de la convocatoria CaixaResearch de Salud, el Consejo Europeo de Investigación (ERC), el proyecto MycoSynVac en el marco del programa Horizonte 2020 de investigación e innovación de la Unión Europea, la Generalitat de Catalunya y el Instituto de Salud Carlos III.
El nuevo tratamiento se dirige específicamente a los biofilms, colonias de células bacterianas que se pegan sobre una superficie. Las superficies de los implantes médicos presentan las condiciones ideales para el desarrollo de biofilms, donde forman estructuras impenetrables que impiden que los antibióticos o el sistema inmunitario humano destruyan las bacterias allí incrustadas. Las bacterias asociadas a los biofilms pueden ser mil veces más resistentes a los antibióticos que las bacterias libres.
El Staphylococcus aureus es una de las especies de bacterias más comunes asociadas a los biofilms. Las infecciones por S. Aureus no responden a los antibióticos convencionales, y es necesario intervenir quirúrgicamente a los pacientes para extraer los implantes médicos infectados. Las terapias alternativas pasan por el uso de anticuerpos o enzimas, pero son tratamientos de amplio espectro altamente tóxicos para los tejidos y las células sanas, y causan efectos secundarios no deseados.
La hipótesis de partida consistió en introducir organismos vivos que produjeran enzimas directamente en las inmediaciones de los biofilms como una forma más segura y económica para tratar las infecciones. Las bacterias son un vector ideal, ya que tienen genomas pequeños que pueden modificarse mediante la simple manipulación genética.
El equipo científico escogió modificar el Mycoplasma pneumoniae, una especie común de bacterias que carece de pared celular. Esto permite liberar más fácilmente las moléculas terapéuticas que combaten la infección y, a la vez, contribuye a evitar su detección por parte del sistema inmunitario humano. Otras ventajas de usar M. pneumoniae como vector incluyen el bajo riesgo de que desarrolle nuevas habilidades y su incapacidad de transferir sus genes modificados a otros microbios de los alrededores.
El M. pneumoniae se modificó previamente para que no causara enfermedades. Alteraciones adicionales permitieron que produjera dos enzimas distintas que disuelven los biofilms y atacan las paredes celulares de las bacterias incrustadas. El equipo científico también modificó las bacterias para que secretaran enzimas antimicrobianas de forma más eficiente.
El equipo científico tiene como primer objetivo usar las bacterias modificadas para tratar el desarrollo de biofilms alrededor de tubos endotraqueales, ya que M. pneumoniae está naturalmente adaptado al pulmón. “Nuestra tecnología, basada en la biología sintética y en la bioterapéutica viva, ha sido diseñada para cumplir con todos los estándares de seguridad y eficacia para su aplicación en el pulmón, siendo las enfermedades respiratorias uno de los primeros objetivos. Nuestro próximo reto es abordar la producción y fabricación a gran escala, y esperamos comenzar los ensayos clínicos en 2023,” declara María Lluch, co-autora del estudio y directora científica de Pulmobiotics.
Las bacterias modificadas también podrán aplicarse a largo plazo en otras enfermedades. “Las bacterias son vehículos ideales para la ‘medicina viva’ porque pueden transportar cualquier proteína terapéutica para tratar la causa de una enfermedad. Uno de los grandes beneficios de la tecnología es que una vez que llegan a su destino, los vectores bacterianos ofrecen una producción continua y localizada de la molécula terapéutica. Como cualquier vehículo, nuestras bacterias pueden modificarse con cargas distintas dirigidas a enfermedades diferentes, con más aplicaciones potenciales en el futuro,” dice el profesor de investigación Luis Serrano, director del CRG y co-autor del estudio.
EN CATALÀ
Un equip científic crea una ‘píndola viva’ per tractar infeccions resistents als antibiòtics
Un equip científic al Centre de Regulació Genòmica (CRG) i Pulmobiotics S.L. ha creat la primera ‘píndola viva’ per tractar bacteris resistents als antibiòtics que s’expandeixen per les superfícies dels implants mèdics. L’equip científic desenvolupà el tractament eliminant una habilitat comuna dels bacteris que causa la malaltia, transformant-la per a què ataqui els microbis perjudicials.
El tractament experimental es provà en catèters infectats in vitro, ex vivo i in vivo. Es tractaren amb èxit infeccions mitjançant els tres mètodes de prova. Segons els autors, la inoculació de la teràpia sota la pell dels ratolins acabà amb les infeccions en el 82% dels animals tractats.
Aquestes troballes són un primer pas molt important per al desenvolupament de nous tractaments de les infeccions que afecten els implants mèdics, tals com catèters, marcapassos i implants prostètics. Aquestes infeccions són altament resistents als antibiòtics i són la causa del 80% de totes les infeccions contretes als hospitals.
L’estudi es publica avui a la revista Molecular Systems Biology. Aquest treball ha rebut el suport de la Fundació ‘la Caixa’ a través de la convocatòria d’ajuts CaixaResearch de Salut, el Consell Europeu de Recerca (ERC), el projecte MycoSynVac en el marc del programa Horitzó 2020 de recerca i innovació de la Unió Europea, la Generalitat de Catalunya i l’Instituto de Salud Carlos III.
El nou tractament s’adreça específicament als biofilms, colònies de cèl·lules bacterianes que s’enganxen sobre una superfície. Les superfícies dels implants mèdics presenten les condicions ideals per al desenvolupament de biofilms, on formen estructures impenetrables que impedeixen que els antibiòtics o el sistema immunitari humà destrueixin els bacteris que s’hi incrusten. Els bacteris associats als biofilms poden ésser mil vegades més resistents als antibiòtics que els bacteris lliures.
L’Staphylococcus aureus és una de les espècies de bacteris més comunes associades a biofilms. Les infeccions per S. Aureus no responen als antibiòtics convencionals, i és necessari intervenir quirúrgicament els pacients per extraure els implants mèdics infectats. Les teràpies alternatives passen per l’ús d’anticossos o enzims, però són tractaments d’ampli espectre altament tòxics per als teixits i les cèl·lules sanes, i causen efectes secundaris no desitjats.
La hipòtesi de partida consistí en introduir organismes vius que produïssin enzims directament en les immediacions dels biofilms com una forma més segura i econòmica per tractar les infeccions. Els bacteris són un vector ideal, ja que tenen genomes petits que poden modificar-se mitjançat la simple manipulació genètica.
L’equip científic escollí modificar el Mycoplasma pneumoniae, una espècie comuna de bacteris que no tenen paret cel·lular. Això permet alliberar més fàcilment les molècules terapèutiques que combaten la infecció i, alhora, contribueix a evitar la seva detecció per part del sistema immunitari humà. Altres avantatges d’emprar M. pneumoniae com a vector inclouen el baix risc que desenvolupi noves habilitats i la seva incapacitat de transferir el seus gens modificats a d’altres microbis dels voltants.
L’M. pneumoniae es modificà prèviament per a què no causés malalties. Alteracions addicionals permeteren que produís dos enzims distints que dissolen els biofilms i ataquen les parets cel·lulars dels bacteris incrustats. L’equip científic també modificà els bacteris per a què secretessin enzims antimicrobians de manera més eficient.
L’equip científic té com a primer objectiu emprar els bacteris modificats per tractar el desenvolupament de biofilms al voltant dels tubs endotraqueals, ja que M. pneumoniae està naturalment adaptat al pulmó. “La nostra tecnologia, basada en la biologia sintètica i la bioterapèutica viva, ha estat dissenyada per a complir amb tots els estàndards de seguretat i eficàcia per a la seva aplicació al pulmó, essent les malalties respiratòries un dels primers objectius. El nostre proper repte és abordar la producció i fabricació a gran escala, i esperem començar els assajos clínics al 2023,” declara la Maria Lluch, co-autora de l’estudi i directora científica de Pulmobiotics.
Els bacteris modificats també podran aplicar-se a llarg termini en d’altres malalties. “Els bacteris són vehicles ideals per a la ‘medicina viva’ perquè poden transportar qualsevol proteïna terapèutica per tractar la causa d’una malaltia. Un dels grans beneficis de la tecnologia és que un cop arriben al seu destí, els vectors bacterians ofereixen una producció continuada i localitzada de la molècula terapèutica. Com qualsevol vehicle, els nostres bacteris poden modificar-se amb càrregues distintes adreçades a malalties diferents, amb més aplicacions potencials en el futur,” diu el professor d’investigació ICREA Luis Serrano, director del CRG i co-autor de l’estudi.