NOTICIAS
NOTICIAS
AI Spots Cancer and Viral Infections at Nanoscale Precision
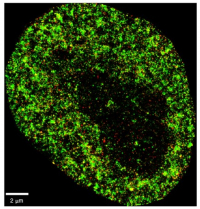
A super-resolution image of a HeLa cancer cell. The image uses two colours to show specific nuclear components which allow researchers to see detailed structures within the cell nucleus at nanoscale resolution. Credit: Zhong Limei
Researchers at the Centre for Genomic Regulation (CRG), the University of the Basque Country (UPV/EHU), Donostia International Physics Center (DIPC) and the Fundación Biofisica Bizkaia (FBB, located in Biofisika Institute) have developed an artificial intelligence which can differentiate cancer cells from normal cells, as well as detect the very early stages of viral infection inside cells. The findings, published today in a study in the journal Nature Machine Intelligence, pave the way for improved diagnostic techniques and new monitoring strategies for disease.
The tool, AINU (AI of the NUcleus), scans high-resolution images of cells. The images are obtained with a special microscopy technique called STORM, which creates a picture that captures many finer details than what regular microscopes can see. The high-definition snapshots reveal structures at nanoscale resolution.
A nanometre (nm) is one-billionth of a metre, and a strand of human hair is about 100,000nm wide. The AI can detect rearrangements inside cells as small as 20nm, or 5,000 times smaller than the width of a human hair. These alterations are too small and subtle for human observers to find with traditional methods alone.
“The resolution of these images is powerful enough for our AI to recognise specific patterns and differences with remarkable accuracy, including changes in how DNA is arranged inside cells, helping spot alterations very soon after they occur. We think that, one day, this type of information can buy doctors valuable time to monitor disease, personalise treatments and improve patient outcomes,” says ICREA Research Professor Pia Cosma, co-corresponding author of the study and researcher at the Centre for Genomic Regulation in Barcelona.
‘Facial recognition’ at the molecular level
AINU is a convolutional neural network, a type of AI specifically designed to analyse visual data like images. Examples of convolutional neural networks include AI tools which enables users to unlock smartphones with their face, or others used by self-driving cars to understand and navigate environments by recognising objects on the road.
In medicine, convolutional neural networks are used to analyse medical images like mammograms or CT scans and identify signs of cancer that might be missed by the human eye. They can also help doctors detect abnormalities in MRI scans or X-ray images, helping make a faster and more accurate diagnosis.
AINU detects and analyses tiny structures inside cells at the molecular level. The researchers trained the model by feeding it with nanoscale-resolution images of the nucleus of many different types of cells in different states. The model learned to recognize specific patterns in cells by analysing how nuclear components are distributed and arranged in three-dimensional space.
For example, cancer cells have distinct changes in their nuclear structure compared to normal cells, such as alterations to how their DNA is organised or the distribution of enzymes within the nucleus. After training, AINU could analyse new images of cell nuclei and classify them as cancerous or normal based on these features alone.
The nanoscale resolution of the images enabled the AI detect changes in a cell's nucleus as soon as one hour after it was infected by the herpes simplex virus type-1. The model could detect the presence of the virus by finding slight differences in how tightly DNA is packed, which happens when a virus starts to alter the structure of the cell's nucleus.
“Our method can detect cells that have been infected by a virus very soon after the infection starts. Normally, it takes time for doctors to spot an infection because they rely on visible symptoms or larger changes in the body. But with AINU, we can see tiny changes in the cell's nucleus right away,” says Ignacio Arganda-Carreras, co-corresponding author of the study and Ikerbasque Research Associate at UPV/EHU and affiliated with the FBB-Biofisika Institute and the DIPC in San Sebastián/Donostia.
“Researchers can use this technology to see how viruses affect cells almost immediately after they enter the body, which could help in developing better treatments. In hospitals and clinics, AINU could be used to quickly diagnose infections from a simple blood or tissue sample, making the process faster and more accurate,” adds Limei Zhong, co-first author of the study and researcher at the Guangdong Provincial People's Hospital (GDPH) in Guangzhou, China.
Laying the groundwork for clinical readiness
The researchers have to overcome important limitations before the technology is ready to be tested or deployed in a clinical setting. For example, STORM images can only be taken with specialized equipment normally only found in biomedical research labs. Setting up and maintaining the imaging systems required by the AI is a significant investment in both equipment and technical expertise.
Another constraint is that STORM imaging typically analyses only a few cells at a time. For diagnostic purposes, especially in clinical settings where speed and efficiency are crucial, doctors would need to capture many more numbers of cells in a single image to be able to detect or monitor a disease.
“There are many rapid advances in the field of STORM imaging which mean that microscopes may soon be available in smaller or less specialized labs, and eventually, even in the clinic. The limitations of accessibility and throughput are more tractable problems than we previously thought and we hope to carry out preclinical experiments soon,” says Dr. Cosma.
Though clinical benefits might be years away, AINU is expected to accelerate scientific research in the short term. The researchers found the technology could identify stem cells with very high precision. Stem cells can develop into any type of cell in the body, an ability known as pluripotency. Pluripotent cells are studied for their potential in helping repair or replace damaged tissues.
AINU can make the process of detecting pluripotent cells quicker and more accurate, helping make stem cell therapies safer and more effective. “Current methods to detect high-quality stem cells rely on animal testing. However, all our AI model needs to work is a sample that is stained with specific markers that highlight key nuclear features. As well as being easier and faster, it can accelerate stem cell research while contributing to the shift in reducing animal use in science,” says Davide Carnevali, first author of the research and researcher at the CRG.
EN CASTELLANO
La IA detecta el cáncer y las infecciones virales con precisión nanométrica
Un equipo científico del Centro de Regulación Genómica (CRG), la Universidad del País Vasco (UPV/EHU), el Donostia International Physics Center (DIPC) y la Fundación Biofísica Bizkaia (FBB, localizado en Instituto Biofísica) ha desarrollado una inteligencia artificial que puede diferenciar las células cancerosas de las normales, así como detectar las fases más tempranas de la infección viral en el interior de las células. Los hallazgos, publicados hoy en la revista Nature Machine Intelligence, abren el camino para desarrollar nuevas técnicas de diagnóstico y estrategias de seguimiento de enfermedades.
La herramienta, AINU (AI of the NUcleus), escanea imágenes de alta resolución de las células. Las imágenes se obtienen con una técnica especial de microscopía llamada STORM, que crea una imagen que captura muchos más detalles de los que pueden ver los microscopios normales. Las instantáneas de alta definición revelan estructuras con una resolución a escala nanométrica.
Un nanómetro (nm) es una milmillonésima parte de un metro, y un pelo individual de cabello humano tiene unos 100.000 nm de ancho. La IA puede detectar reordenamientos dentro de las células tan pequeños como 20 nm, o 5.000 veces más pequeños que el ancho de un cabello humano. Estas alteraciones son demasiado pequeñas y sutiles para que los observadores humanos las detecten con los métodos tradicionales.
“La resolución de estas imágenes es lo suficientemente potente como para que nuestra IA reconozca patrones específicos y diferencias con una precisión notable, incluidos los cambios en la forma en que se organiza el ADN dentro de las células, lo que ayuda a detectar alteraciones muy pronto después de que se produzcan. Creemos que, algún día, este tipo de información puede permitir a los médicos ganar tiempo para controlar la enfermedad, personalizar los tratamientos y mejorar los resultados de los pacientes”, afirma la profesora de investigación ICREA Pia Cosma, coautora principal del estudio e investigadora del Centro de Regulación Genómica (CRG) en Barcelona.
“Reconocimiento facial” a nivel molecular
AINU es una red neuronal convolucional, un tipo de IA diseñada específicamente para analizar datos visuales como las imágenes. Algunos ejemplos incluyen herramientas de IA que permiten a los usuarios desbloquear teléfonos inteligentes con su cara u otras que utilizan los coches autónomos para comprender y navegar por entornos mediante el reconocimiento de objetos en la carretera.
En medicina, las redes neuronales convolucionales se utilizan para analizar imágenes médicas como las mamografías o las tomografías computarizadas e identificar signos de cáncer que el ojo humano podría pasar por alto. También pueden ayudar a los médicos a detectar anomalías en resonancias magnéticas o imágenes de rayos X, lo que ayuda a realizar un diagnóstico más rápido y preciso.
AINU detecta y analiza estructuras diminutas dentro de las células a nivel molecular. El equipo científico entrenó al modelo alimentándolo con imágenes de resolución nanométrica del núcleo de muchos tipos diferentes de células en diferentes estados. El modelo aprendió a reconocer patrones específicos en las células al analizar cómo se distribuyen y organizan los componentes nucleares en el espacio tridimensional.
Por ejemplo, las células cancerosas tienen cambios distintivos en su estructura nuclear en comparación con las células normales, como alteraciones en la forma en que se organiza su ADN o la distribución de enzimas dentro del núcleo. Después del entrenamiento, AINU pudo analizar nuevas imágenes de núcleos celulares y clasificarlas como cancerosas o normales basándose solo en estas características.
La resolución nanométrica de las imágenes permitió que la IA detectara cambios en el núcleo de una célula solo una hora después de que fuera infectada por el virus del herpes simple tipo 1. El modelo puede detectar la presencia del virus al encontrar pequeñas diferencias en la densidad del ADN, lo que ocurre cuando un virus comienza a alterar la estructura del núcleo de la célula.
“Nuestro método puede detectar células que han sido infectadas por un virus muy pronto después de que comience la infección. Normalmente, los médicos tardan un tiempo en detectar una infección porque se basan en síntomas visibles o cambios más grandes en el cuerpo. Pero con AINU, podemos ver pequeños cambios en el núcleo de la célula de inmediato”, afirma Ignacio Arganda-Carreras, coautor del estudio e investigador asociado de Ikerbasque en la UPV/EHU y afiliado al FBB-Instituto Biofísica y al DIPC en San Sebastián/Donostia.
“Se puede usar esta tecnología para ver cómo los virus afectan a las células casi inmediatamente después de entrar en el cuerpo, lo que podría ayudar a desarrollar mejores tratamientos. En hospitales y en la clínica, AINU podría utilizarse para diagnosticar infecciones a partir de una simple muestra de sangre o tejido, lo que hace que el proceso sea más rápido y preciso”, añade Limei Zhong, coautora principal del estudio e investigadora del Hospital Popular Provincial de Guangdong (GDPH) en Guangzhou, China.
Sentando las bases para la preparación clínica
Los autores del estudio avisan que aún tienen que superar importantes limitaciones antes de que la tecnología esté lista para ser probada o implementada en un entorno clínico. Por ejemplo, las imágenes STORM solo se pueden tomar con equipos especializados que normalmente solo se encuentran en laboratorios de investigación biomédica. La instalación y el mantenimiento de los sistemas de imágenes que requiere la IA es una inversión importante tanto en equipos como en competencias técnicas.
Otra limitación es que las imágenes STORM analizan pocas células a la vez. Para fines de diagnóstico, especialmente en entornos clínicos donde la velocidad y la eficiencia son cruciales, los médicos necesitarían capturar muchas más células en una sola imagen para poder detectar o monitorear una enfermedad.
"Hay muchos avances rápidos en el campo de las imágenes STORM, lo que significa que los microscopios pronto podrán estar disponibles en laboratorios más pequeños o menos especializados y, finalmente, incluso en la clínica. Las limitaciones de accesibilidad y rendimiento son problemas más manejables de lo que pensábamos y esperamos realizar experimentos preclínicos pronto", dice la Dra. Cosma.
Aunque los beneficios clínicos pueden tardar años en llegar, se espera que, a corto plazo, la AINU acelere la investigación científica. Los autores del estudio descubrieron que la tecnología también puede identificar células madre con una precisión muy alta. Estas células se pueden convertir en cualquier tipo de célula del cuerpo y se estudian por su potencial para ayudar a reparar o reemplazar tejidos dañados.
La AINU puede hacer que el proceso de detección de células madre sea más rápido y preciso, y ayudaría que las terapias resultantes sean más seguras y efectivas. “Los métodos actuales para detectar células madre de alta calidad se basan en pruebas con animales. Sin embargo, todo lo que nuestro modelo de IA necesita para funcionar es una muestra que se tiñe con marcadores específicos que resaltan las características nucleares clave. Además de ser más fácil y rápido, puede acelerar la investigación con células madre y, al mismo tiempo, contribuir al cambio en la reducción del uso de animales en la ciencia”, concluye Davide Carnevali, primer autor del estudio e investigador del CRG.
EN CATALÀ
La IA detecta el càncer i les infeccions virals amb precisió nanomètrica
Un equip científic del Centre de Regulació Genòmica (CRG), la Universitat del País Basc (UPV/EHU), el Donostia International Physics Center (DIPC) i la Fundació Biofísica Bizkaia (FBB, localitzat a Institut Biofísica) ha desenvolupat una intel·ligència artificial que pot diferenciar les cèl·lules canceroses de les normals, així com detectar les fases més primerenques de la infecció viral a l'interior de les cèl·lules. Les troballes, publicades avui a la revista Nature Machine Intelligence, obren el camí per desenvolupar noves tècniques de diagnòstic i estratègies de seguiment de malalties.
L'eina, AINU (AI of the NUcleus), escaneja imatges d'alta resolució de les cèl·lules. Les imatges s'obtenen amb una tècnica especial de microscòpia anomenada STORM, que crea una imatge que captura molts més detalls dels que poden veure els microscopis normals. Les instantànies d' alta definició revelen estructures amb una resolució a escala nanomètrica.
Un nanòmetre (nm) és una milmillonèsima part d'un metre, i un pèl individual de cabell humà té uns 100.000 nm d'ample. La IA pot detectar reordenaments dins de les cèl·lules tan petites com 20 nm, o 5.000 vegades més petits que l'ample d'un cabell humà. Aquestes alteracions són massa petites i subtils perquè els observadors humans les detectin amb els mètodes tradicionals.
"La resolució d'aquestes imatges és prou potent com perquè la nostra IA reconegui patrons específics i diferències amb una precisió notable, inclosos els canvis en la forma en què s'organitza l'ADN dins de les cèl·lules, cosa que ajuda a detectar alteracions ben aviat després que es produeixin. Creiem que, algun dia, aquest tipus d'informació pot permetre als metges guanyar temps per controlar la malaltia, personalitzar els tractaments i millorar els resultats dels pacients", afirma la professora de recerca ICREA Pia Cosma, coautora principal de l'estudi i investigadora del Centre de Regulació Genòmica (CRG) a Barcelona.
"Reconeixement facial" a nivell molecular
AINU és una xarxa neuronal convolucional, un tipus d'IA dissenyada específicament per analitzar dades visuals com les imatges. Alguns exemples inclouen eines d'IA que permeten als usuaris desbloquejar telèfons intel·ligents amb la seva cara o altres que utilitzen els cotxes autònoms per comprendre i navegar per entorns mitjançant el reconeixement d'objectes a la carretera.
En medicina, les xarxes neuronals convolucionals s'utilitzen per analitzar imatges mèdiques com les mamografies o les tomografies computades i identificar signes de càncer que l'ull humà podria passar per alt. També poden ajudar els metges a detectar anomalies en ressonàncies magnètiques o imatges de raigs X, la qual cosa ajuda a realitzar un diagnòstic més ràpid i precís.
AINU detecta i analitza estructures diminutes dins de les cèl·lules a nivell molecular. L'equip científic va entrenar el model alimentant-lo amb imatges de resolució nanomètrica del nucli de molts tipus diferents de cèl·lules en diferents estats. El model va aprendre a reconèixer patrons específics en les cèl·lules en analitzar com es distribueixen i organitzen els components nuclears en l'espai tridimensional.
Per exemple, les cèl·lules canceroses tenen canvis distintius en la seva estructura nuclear en comparació amb les cèl·lules normals, com alteracions en la forma en què s'organitza el seu ADN o la distribució d'enzims dins del nucli. Després de l'entrenament, AINU va poder analitzar noves imatges de nuclis cel·lulars i classificar-les com a canceroses o normals basant-se només en aquestes característiques.
La resolució nanomètrica de les imatges va permetre que la IA detectés canvis en el nucli d'una cèl·lula només una hora després que fos infectada pel virus de l'herpes simple tipus 1. El model pot detectar la presència del virus en trobar petites diferències en la densitat de l'ADN, cosa que passa quan un virus comença a alterar l'estructura del nucli de la cèl·lula.
"El nostre mètode pot detectar cèl·lules que han estat infectades per un virus molt aviat després que comenci la infecció. Normalment, els metges tarden un temps a detectar una infecció perquè es basen en símptomes visibles o canvis més grans al cos. Però amb AINU, podem veure petits canvis en el nucli de la cèl·lula immediatament", afirma Ignacio Arganda-Carreras, coautor de l'estudi i investigador associat d'Ikerbasque en la UPV/EHU i afiliat al FBB-Institut Biofísica i al DIPC a Sant Sebastià/Donostia.
"Es pot fer servir aquesta tecnologia per veure com els virus afecten les cèl·lules gairebé immediatament després d'entrar al cos, cosa que podria ajudar a desenvolupar millors tractaments. En hospitals i a la clínica, AINU podria utilitzar-se per diagnosticar infeccions a partir d'una simple mostra de sang o teixit, cosa que fa que el procés sigui més ràpid i precís", afegeix Limei Zhong, coautora principal de l'estudi i investigadora de l'Hospital Popular Provincial de Guangdong (GDPH) a Guangzhou, Xina.
Asseient les bases per a la preparació clínica
Els autors de l'estudi avisen que encara han de superar importants limitacions abans que la tecnologia estigui llesta per ser provada o implementada en un entorn clínic. Per exemple, les imatges STORM només es poden prendre amb equips especialitzats que normalment només es troben en laboratoris de recerca biomèdica. La instal·lació i el manteniment dels sistemes d'imatges que requereix la IA és una inversió important tant en equips com en competències tècniques.
Una altra limitació és que les imatges STORM analitzen poques cèl·lules alhora. Per a finalitats de diagnòstic, especialment en entorns clínics on la velocitat i l'eficiència són crucials, els metges necessitarien capturar moltes més cèl·lules en una sola imatge per poder detectar o monitorar una malaltia.
"Hi ha molts avenços ràpids en el camp de les imatges STORM, cosa que significa que els microscopis aviat podran estar disponibles en laboratoris més petits o menys especialitzats i, finalment, fins i tot a la clínica. Les limitacions d'accessibilitat i rendiment són problemes més manejables del que pensàvem i esperem realitzar experiments preclínics aviat", diu la Dra. Cosma.
Tot i que els beneficis clínics poden trigar anys a arribar, s'espera que, a curt termini, l'AINU acceleri la investigació científica. Els autors de l'estudi van descobrir que la tecnologia també pot identificar cèl·lules mare amb una precisió molt alta. Aquestes cèl·lules es poden convertir en qualsevol tipus de cèl·lula del cos i s'estudien pel seu potencial per ajudar a reparar o reemplaçar teixits danyats.
L'AINU pot fer que el procés de detecció de cèl·lules mare sigui més ràpid i precís, i ajudaria que les teràpies resultants siguin més segures i efectives. "Els mètodes actuals per detectar cèl·lules mare d'alta qualitat es basen en proves amb animals. No obstant això, tot el que el nostre model d'IA necessita per funcionar és una mostra que es tenyeix amb marcadors específics que ressalten les característiques nuclears clau. A més de ser més fàcil i ràpid, pot accelerar la investigació amb cèl·lules mare i, alhora, contribuir al canvi en la reducció de l'ús d'animals en la ciència", conclou Davide Carnevali, primer autor de l'estudi i investigador del CRG.